本帖最后由 sunsong7 于 2015-12-15 22:35 编辑
9 S$ P1 [4 v9 K9 \" x1 U+ ^9 @- d, c6 E

, D2 L7 W, ^4 e3 A8 C1 L2 N
/ N' L& S/ n7 [$ ^6 g3 H, U$ ]
1970年代Pierce et al 提出“肿瘤是一个发育生物学问题”的理论, 指出肿瘤的发生在很大程度上与发育生物学有着密切的关系。肿瘤细胞亦来自于体细胞,表明肿瘤细胞与胚胎细胞具有相同的全部基因组,其恶性生物学行为归结为6种额外能力的获得,即自给自足生长信号、抗生长信号的不敏感、抵抗细胞死亡、潜力无限的复制能力、持续的血管生成、组织浸润和转移、避免免疫摧毁、促进肿瘤的炎症、 细胞能量异常、基因组不稳定和突变,这些正是细胞微环境调控失调造成基因表达时序错误而非基因突变的结果。诸多的研究表明: 早期胚胎细胞和肿瘤细胞在基因、蛋白、代谢水平以及重要的生物学行为方面存在诸多相似之处。
/ ]' g% f' I# C" W3 f# U9 W+ N2 t+ m# q
9 m8 t4 R6 c/ Y9 V3 N
$ v2 a' x7 e: N0 B l& X
一、肿瘤发生与胚胎发育存在惊人相似
, F: O- W. b! Y" V( }9 t6 [7 s8 {5 F2 y* L: ^# p
1.1 生物学行为:早期胚胎发育的滋养层细胞具有植入子宫内膜的能力, 生殖细胞在迁徙和植入过程“误入”定居并“滋养层化”而产生肿瘤组织。肿瘤细胞通过相似的机制进行侵袭、转移。两者共享相似的免疫逃避、血管形成以及调控机制。
# D+ Q6 a" r- n/ r$ e, x
- L% N' B. z9 @& S0 E
. {: \3 |2 ]0 Z8 X' K3 `1 A3 S2 \6 ]( [1 ^: T/ _3 Q& R0 B
) n% ?; U, b7 T9 c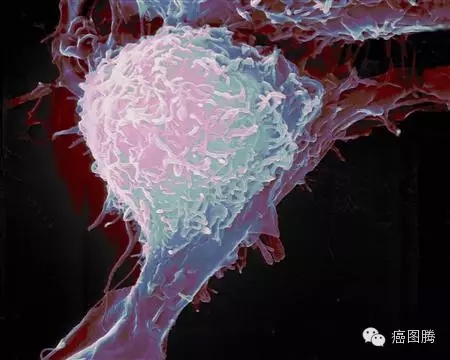
# B! I7 x) m6 c* X- O
胰腺癌细胞侵袭组织 4 B N/ k* H+ |/ @0 ]" t! V
( B! s" c1 [- @( _( W+ ?8 M
, F$ R! K( X* k6 N
. \7 I3 @' B: C; B* k

, }4 K% f8 x) h# w
) K; y2 L+ t z- f胚胎植入滋养层 3 Z# t# n1 T* H. M
* ?: A/ X- ?& W( O* |* Z
4 l! Y5 @$ Y, r3 m
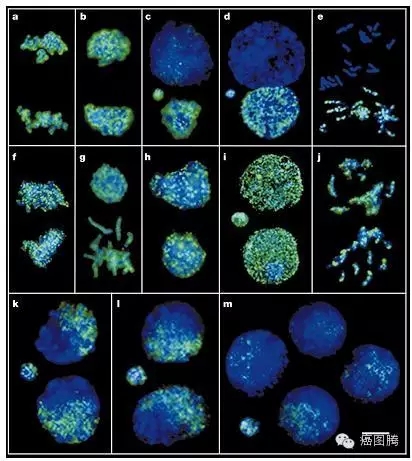
1.2. 基因水平:胚胎植入与肿瘤形成过程均表达OTC-4、c-myc、c-met、c-fms、c-kit、fgf-2、src等癌基因;在早期胚胎发育和肿瘤形成过程中均存在广泛基因组的去甲基化, 而甲基化酶和DNA甲基化转移酶的水平均呈现出非常高的状态;
/ y W8 ]0 k, a
. _. k4 \! I- X J: a- X! m( ^& l
: w3 Y7 P$ ]7 U5 z8 r/ o6 e) ^2 ~- C0 L) T0 f$ I
早期胚胎发育和肿瘤形成过程中均存在广泛基因组的去甲基化 8 O5 B$ Q3 l, p" J
4 h0 d! l- G$ e# M1.3. 蛋白水平:早期胚胎与肿瘤共享生物标志物如甲胎蛋白、癌胚抗原、鳞状细胞抗原、Survivin蛋白、癌抗原199、前列腺特异性抗原、组织多肽特异性抗原等;在胚胎早期发育过程中开始产生的一些激素如人类绒毛膜促性腺激素(HCG)、促甲状腺激素(TSH)也在特定的肿瘤细胞中大量合成 。. }1 O% Q$ ^2 H5 I2 d% K. X5 ^
3 B8 W) r, W O6 d4 ]
6 F" f/ ^+ q, w

' P) f% N7 o2 t5 k' [
Geoffrey Grandjean拍摄的人卵巢癌细胞荧光显微图片,其中DNA染成红色,微管染成绿色
- Z* b- s+ u9 Z, e7 j3 s, @3 @+ i5 J" V
: v0 b' ]( C/ w/ w# S$ D o9 K( q. D1 \
. a' y; I1 P |7 O# e. t, W2 O
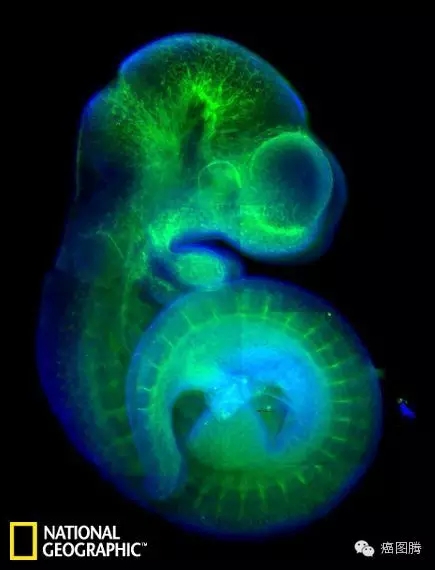
' D4 L$ E' A; s6 Y- K这是一个老鼠胚胎的荧光染色影像,血液用绿色标示,蓝色则表示DNA物质。 " j. o& ^! T8 |# T3 ^
# C! C! ?: Z j! k9 P* \8 ]- D- d- g) K8 T) z1 x; M
4 t3 Y, f$ u, U5 X( M1.4. 代谢水平:肿瘤细胞中特异性酶的活性和其同工酶的谱型都向早期胚胎发育时期靠拢;
( T/ |# U& b. g# R
+ g0 d/ [+ x8 T# F2 \4 u1 _; _* v, x( G9 J5 N3 l$ N' P" X+ w) G3 X/ C9 W

: y& O8 |6 n) Y0 B正在迁徙的癌细胞 ' ]# U% p0 f6 t6 j; ]7 \9 a8 ]
- r& E$ J: g! i; A* G7 s, F
( Y- e8 Z# s) L; X3 M3 b, Q0 r5 D
) W4 x' J; e9 @
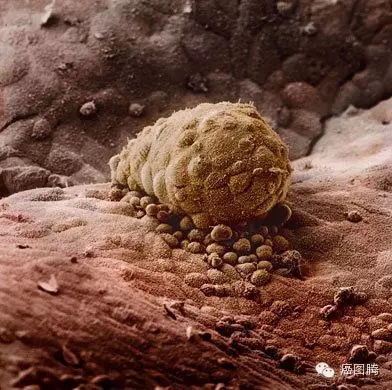
9 J: d. T4 u) e2 @6 @受精卵从输卵管迁移到子宫内膜定植
2 H- {: ~! c* W+ B y- K" S: ~( Z" ~7 B4 A
, ^; P, d* M+ X" E
, Z! j: U E! n, \8 Y7 ^" \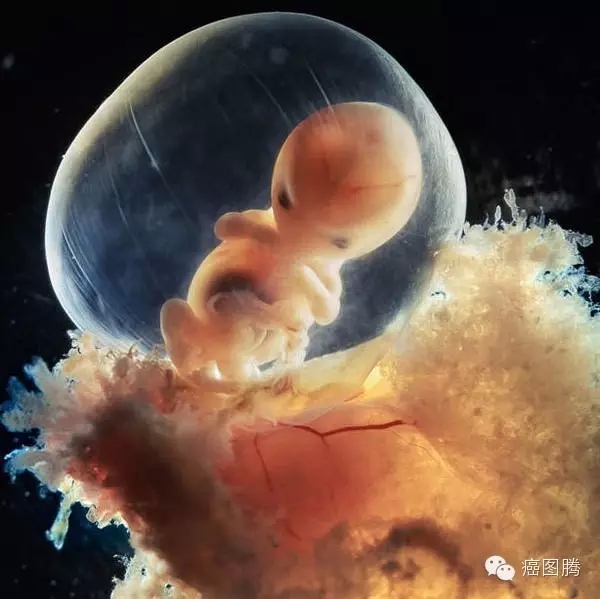
7 \* x* ^+ N* j$ Z- f+ w3 A
6 N e( {: F* `5 k" _/ a# F+ O4 n6 Z胎儿萌图 7 g1 \5 e# C' L4 C* N
+ v% J4 G/ s6 a: L# K
% U+ B2 U% O, i; ]) N
- Y, b( o: q7 a3 D1.5. 免疫逃逸:肿瘤细胞与胚胎滋养层细胞表面主要组织相容性复合物I类分子表达下调或丢失,逃避T细胞的免疫监视,同时表达非经典的人类白细胞抗原-G类分子,逃避NK细胞的识别攻击。早期胚胎发育和肿瘤形成均通过刺激抑制因子IL-4、IL-10来调整宿主的防御反应导致宿主对异常细胞的免疫耐受,分享着相似的免疫学逃逸机制;
$ v: L1 E0 o+ h, `( F3 p, S
) j0 _$ J8 R) B# r% P8 `: [; u7 p$ i( O* {0 }

" u. B, q$ J+ X5 x3 D3 x
) L% ~ D4 X/ _4 I E癌组织萌图 ; R: W' J2 ?: `5 w) z' A& S, t# _
# \( \- R; C4 P% j! }
. x2 Q4 T) W( {% ^
2 B% L% N2 x- k9 P# e. d: J
1.6. 增殖分化:肿瘤细胞和胚胎细胞处于分化早期的细胞并高速增殖,有丝分裂形式相似 ,均有独立生存增殖和迁移的能力;% X: D4 V: E7 k: s* J5 U# l
9 K2 d4 V) i6 k# }( ~
7 Z5 B: S2 q# t) G1 M3 C% l7 q+ G% `
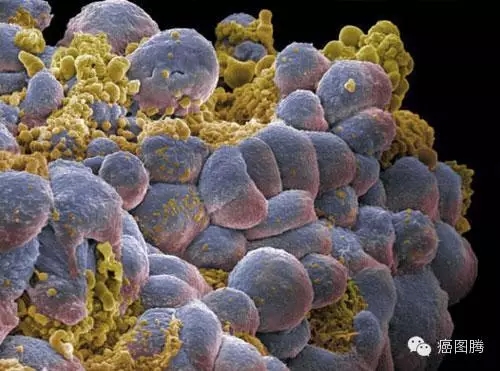
( v; z G4 h' H. k( }& N1 R
9 B; `( u% v2 n T5 D* n
癌细胞增殖 / V6 x0 ] c3 K- L H ]6 T1 B4 U3 P
4 e; H7 D5 O( J: F% v) c
! Y, M; h: a+ _. {4 p
6 L1 `5 T, w: v+ W
1.7. 信号通路:许多调节因子既是细胞恶变的分子机制,也是胚胎发育重要的信号转导通路,胚胎发育与某些肿瘤的发生与发展共享如Hedge、Notch等信号传导通路。& a$ r$ l* k3 Q9 k$ @, R4 @
7 s+ q5 F* N$ `& O8 z1 T
* F- N7 `1 W# ~6 w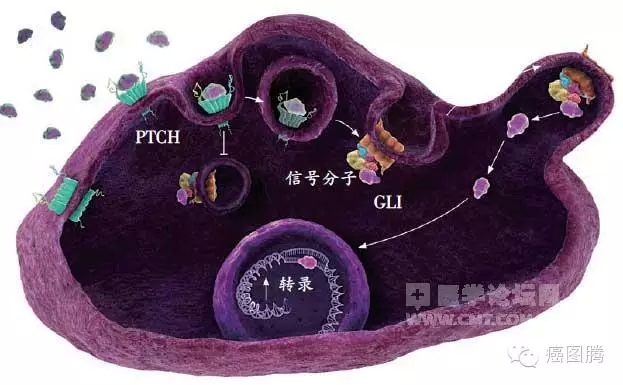
$ [1 N7 N' D# v: Z3 \3 O& m5 [1 w0 W( F7 e
Hedge信号通路 ) q2 N' Z& }% F2 E; t! B( U
* @% e' d" o2 \0 x g
( v5 q; R3 A) x v6 z" G; @' K8 w
% d, a I: L) r1 h
1.8. 永生能力:胚胎干细胞与癌细胞均为永生细胞,他们具有端粒酶活性,衰老时钟被关闭,可以无限增殖。
$ |2 Y# Y, n' ]# K1 B6 ~
# ?) s. \4 o# }' j$ t
8 [$ t0 N0 X5 z0 P g& G
. U" w) }. n8 F+ w癌细胞 / p6 k* I) m7 e
1 }$ |& l$ m* U' U& t; B
% S& U7 J" s4 ^% H% C
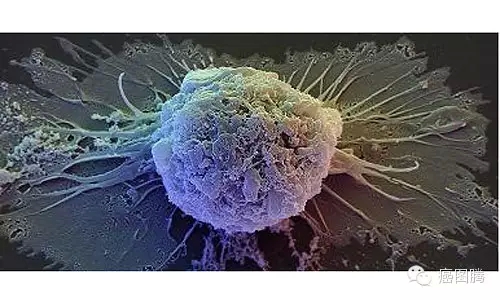
4 Y i% v; @/ S3 |/ c( Y$ h9 {4 U/ _
胚胎干细胞 3 P$ v. Y. a3 f: u+ B
0 X, L8 R7 ?: d2 d' E" B- W; ^# v+ B; C, H" ^
- D" \1 i. E( \
1.9. 血管新生:血管内皮生长因子在肿瘤组织及子宫内膜的胚胎植入点均有高表达 ,并诱导血管生成,肿瘤的侵袭和胚胎植入提供足够的血液供应。胚胎发育过程中在滋养层中形成胎盘绒毛血管通过脐带动脉静脉为胎儿输送营养及排除代谢物,肿瘤细胞增殖过程突破上皮基底膜形成新生血管,血管是肿瘤增殖、转移所必需的。
2 K7 k4 p: i( K/ L/ a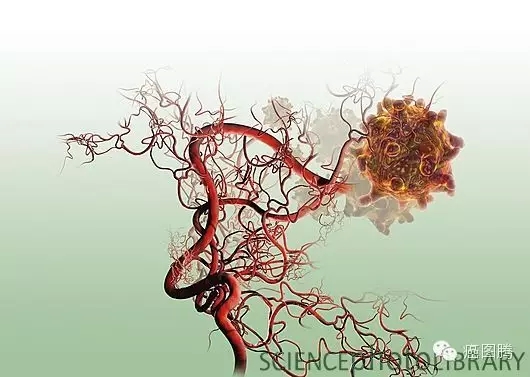
9 R7 c* Y* X7 A0 z" t
+ e1 D% g, n' B肿瘤新生血管 & _0 K+ [7 }, s$ |$ @3 y
$ ?: s: c& p" m/ _9 \0 t
9 D7 A# O+ N& }4 }7 }
3 I7 ?# u0 r5 r' H P
" n/ L( P; q3 d7 V+ S& v& @: D
胎盘中发育出密集的血管 - S6 U# u/ [. X' N. K
( f! S# m, v8 U6 i8 L" a
0 L$ q" g0 g4 ^ u% M! G( Y0 v# i0 M8 x
3 L; [ w* e" R2 d! ]2 z9 J
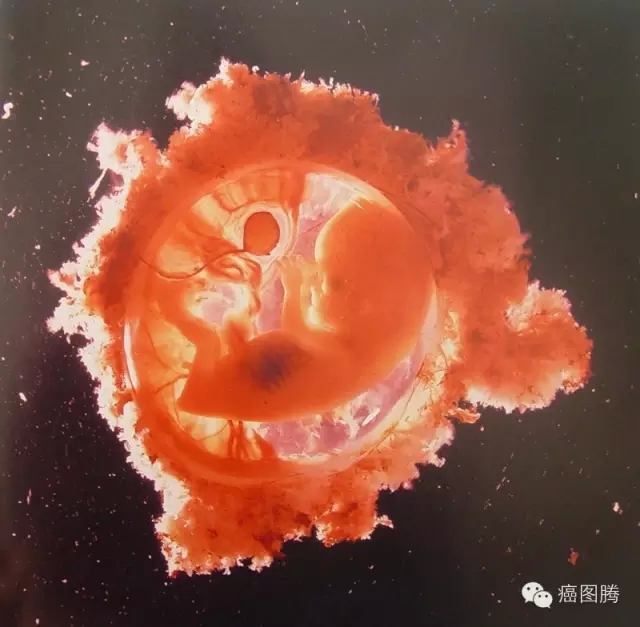
1 k; }4 O7 a# W! Z
孕育新生命 " Z* `( e8 P# f/ _, E* g! {, r
9 @% ^: a3 c! J# \# V6 W2 ?, j
/ t' }! c8 l9 f# ?1 F& [/ K: C' a# I8 i: t( c! W- g) \
二、胎儿是人体最大肿瘤
/ d3 l `+ q; ~! n8 b7 H: k# z; g6 k4 Q3 J: P' x8 H
# _0 ?; u# t. n
胎儿在母体中生长发育,基因组、性别,甚至血型也可以跟母亲不一样。但母亲对于身体中出现这样不听自己控制的一个新生命的却不恐怖,多半还很高兴。胚胎植入胎盘行为与癌细胞组织之间存在惊人的相似性(Murray,1998)
& a/ Q9 o7 x* C' G$ g* n- D6 U9 P5 n
7 q, o. g9 Z4 y+ M' y

! ?$ t8 N% J/ N$ E7 L
0 u$ H: O# C( u+ C) k7 O# M
胎儿四维彩超图
, S: k7 r9 J8 ]" y
7 k S* n: I- X* N1 C! r
' m4 r5 P" ~0 V7 q0 V7 a' j3 m
# y; V6 m2 J. t5 X* N三、肿瘤是组织的胚胎& M. P" A3 u \
8 m1 g, ~9 R! ]8 i& j+ L2 _, U9 Z) r
肿瘤细胞与胚胎干细胞在一定条件下具有互变性,在胚性微环境中肿瘤细胞可像受精卵一样参与正常组织发育,在错误的成体组织微环境中胚胎干细胞也可以形成恶性肿瘤。1871年病理学家Virchow等认为肿瘤来源于发育过程中某些潜伏的胚胎残余组织。
/ F5 K. m9 F! w/ a# q5 J8 N- i5 L! E" D9 {
2 g" U- y7 h% K3 e
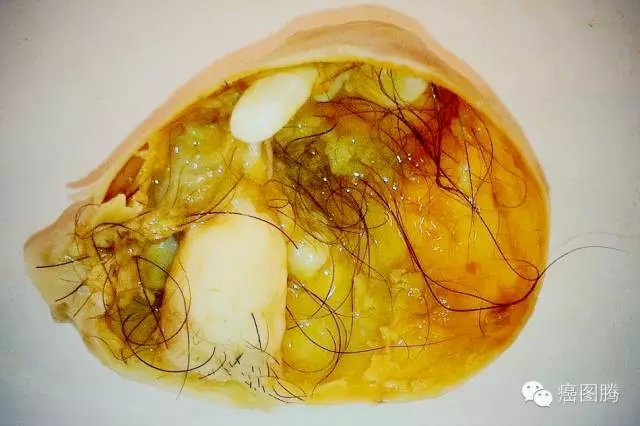
+ s& L3 ]; U: x; z Q
畸胎瘤中含有胚胎干细胞,胚胎干细胞可形成畸胎瘤 ' I& ^: q" M2 K
- ]" \$ S" M' j# K" P8 V0 r- {
# H/ L0 {+ a( P* W7 A, H9 D
; C) V4 L3 x5 y: ?6 r. f四、癌症是衰老疾病
! n- g8 N4 `# q8 u9 e0 |2 `; B( w
3 o' e8 B( Z' @! {机体衰老过程中一些器官会启动增生机制对抗衰老,这种机制与胚胎发育时期的表现十分相似。如同母体在子宫孕育新的个体一样,肿瘤患者器官中也可长出新生组织。所不同的是十个月怀胎孕育一个新生命离开母体,而后者癌肿瘤留在体内破坏或夺去母体生命。( I; g. t" k# q* c
9 g# c+ q: {5 ]% M4 t/ _* z: q4 W p- n: n

/ a* v+ _* c5 Y+ Y2 W4 N生命的轮回 $ |- U. O' [. w& f7 I
3 g' y% A2 U+ \6 [3 |2 z. X+ T1 ~' j5 v( |$ O4 z! V+ P
+ Q- ?1 w% b( f' e3 m7 `. ?: \5 ~( d$ E' l$ V; t2 n' |9 K; U5 n
五、佛曰: 癌胚如来
# w9 ]( B' Y M p7 L9 e
3 I. J G: \* S5 E, M6 c* E道生一,一生二,二生三,三生万物;六合之内,万千世界, 千变万化,千姿百态;万物生灵,负阴抱阳,生生不息。9 C# ]$ z: K0 l( J4 J: C
- S$ I- |0 E3 @$ ]# ~
! r; v( g/ N2 g5 w4 u. g+ C) c
吾既是汝 汝既是吾
% C& Y! Z1 @ J. A; j2 F8 D9 W; W9 |* Z- r# Y
参考文献
5 ~+ C; z, L! ~; e M
) K7 s& \! |6 X$ Q' W) Q6 WHanahan D, Weinberg R A. Hallmarks of cancer: the next generation[J]. cell, 2011, 144(5): 646-674.
* \; I( \& n' U+ Q' ^ `( S( D. c) y9 ?( {
' J9 l* f1 d2 }/ Q# \4 M0 _8 F& S
Hanahan D, Weinberg R A. The hallmarks of cancer[J]. cell, 2000, 100(1): 57-70.
- U3 X4 k1 s5 e
8 n4 _( k+ d, j# N$ G0 |, ?& tPierce GB. The cancer cell and its control by the embryo. Rous-Whipple Award lecture. Am J Pathol 1983; 113: 117-124& g) E% i4 |$ F! t' D
1 `) N; ^. }+ @* Z: i
h3 o0 _7 _& w4 ]5 B6 uMurray M J, Lessey B A. Embryo implantation and tumor metastasis: common pathways of invasion and angiogenesis[C]//Seminars in reproductive endocrinology. 1998, 17(3): 275-290.
3 d3 g. K' S- B. q( Z
/ O! j% \& x4 K9 r1 K; r- r$ C" L+ T. ]- _
Virchow R L K. Die Cellularpathologie: in ihrer Begründung auf physiologische und pathologische Gewebelehre[M]. Verlag von August Hirschwald, Unter den Linden No. 68, 1871.5 c& I0 ~) P) f' H9 ^ u
6 n: p1 I/ B- K0 T& W7 K7 S' _
Mayer, W., A. Niveleau, et al. (2000). "Demethylation of the zygotic paternal genome." Nature 403(6769): 501-2.
( D' m. @, Q2 ~, L5 k1 B( g' k
8 z- S: B5 T+ H9 O( J8 D% Z4 STzukerman M, Rosenberg T, Ravel Y, et al. An experimental platform for studying growth and invasiveness of tumor cells within teratomas derived from human embryonic stem cells[J]. Proceedings of the National Academy of Sciences, 2003, 100(23): 13507-13512.
. e: V6 @7 W6 @, g: H
3 Z0 X& m p/ L/ eKim N W, Piatyszek M A, Prowse K R, et al. Specific association of human telomerase activity with immortal cells and cancer[J]. Science, 1994, 266(5193): 2011-2015.& N, b9 \" {' y( k9 o/ i
Brinster R L. The effect of cells transferred into the mouse blastocyst on subsequent development. J Exp Med, 1974, 140(4): 1049~1056
0 Z5 T |) E- g: I1 l' ]1 V/ l' y) L$ e5 e' A, U9 f+ c" @ T
Papaioannou V E, Waters B K, Rossant J. Interactions between diploid embryonal carcinoma cells and early embryonic cells. Cell Differ, 1984, 15(2-4): 175~179
9 u4 f, ^4 k# {5 G+ K
. k; T; _1 H; K/ @1 c0 B0 O
! D) P* P$ r8 a7 d
) j$ F9 i+ s. O3 [' F; f( z: B! I- E" O/ t% M* H" h) e
' W x; ~4 q$ A$ s5 K! [/ V1 K
欢迎关注《癌图腾》,转载请注明来源并附原文链接,图片源自网络。
! k# v2 I$ H* P, N# U4 V P5 Z6 M9 W' }, r
% H5 e8 _* J6 ^! _$ Y! V$ p$ K2 a- j; t9 C2 \; P$ W+ @9 s: ~
|
