+ r) O7 z! G* r
2 X _9 N" N% m) T* g; s5 K3 K
 " o: `& M; i; X0 c " o: `& M; i; X0 c
【艾米丽的故事】2010年刚过完5岁生日的艾米丽(Emily Whitehead),不幸被诊断出急性淋巴细胞白血病,在进行首轮化疗时受到感染,差点失去双腿。后来病情复发,她又接受了治疗,并排期做骨髓移植手术。等待期间,病情再度复发,这时医生们已经无计可施。2012年艾米丽参与了一项史无前例的试验性疗法,接受Carl June博士的CART19细胞回输。她的体内发生了超强的免疫反应,大量免疫细胞“特种兵”正在剿杀她体内的癌细胞。连续几天发高烧,艾米丽不得不入院治疗。高烧下的她产生了幻觉,问爸爸:“我房间里怎么有池塘?”经历了噩梦般的连续高烧后,艾米丽最终挣脱了死神的束缚重新醒了过来。现在,Emily已经12岁,正在健康成长。她的体内仍然能检测到存活的CAR-T细胞。
% C) T2 q8 d* Q" z
& ^2 Y; ]! P7 G" o! N0 E5 V5 p6 o7 W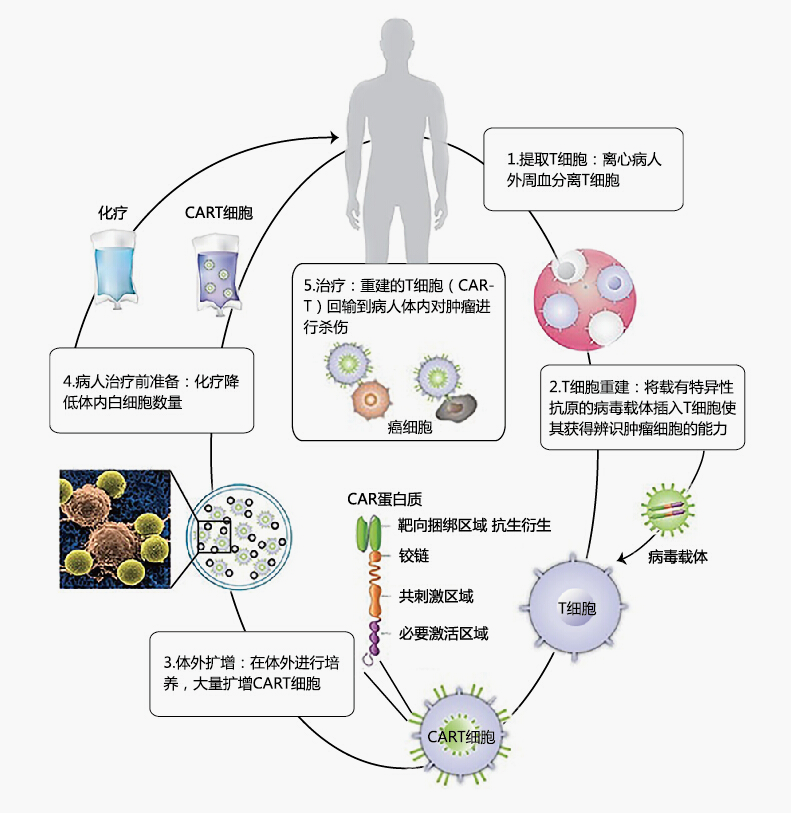
【CAR-T上市】近日,美国FDA批准首个CAR-T细胞产品CTL019,用于治疗25岁以下复发性或难治性B-细胞急性淋巴细胞白血病患者。CAR-T疗法(Chimeric Antigen Receptor T-Cell Immunotherapy),指的是嵌合抗原受体T细胞免疫疗法。CAR-T细胞疗法可以为每一个患者量身定制,基本程序是,1)分离:采集病人血液,分离血液成分提取免疫T细胞,2)修饰:通过对患者的T细胞(人体的一种免疫细胞)进行基因改造,使其可以杀死体内的癌细胞。3)扩增:体外培养,大量扩增CAR-T细胞。4.化疗:对病人进行小剂量化疗预处理,使免疫系统能留出一些空间。5)回输:把扩增好的CAR-T细胞回输到病人体内。 3 h: j2 b0 h) `7 y, D
. s2 u& K& }: U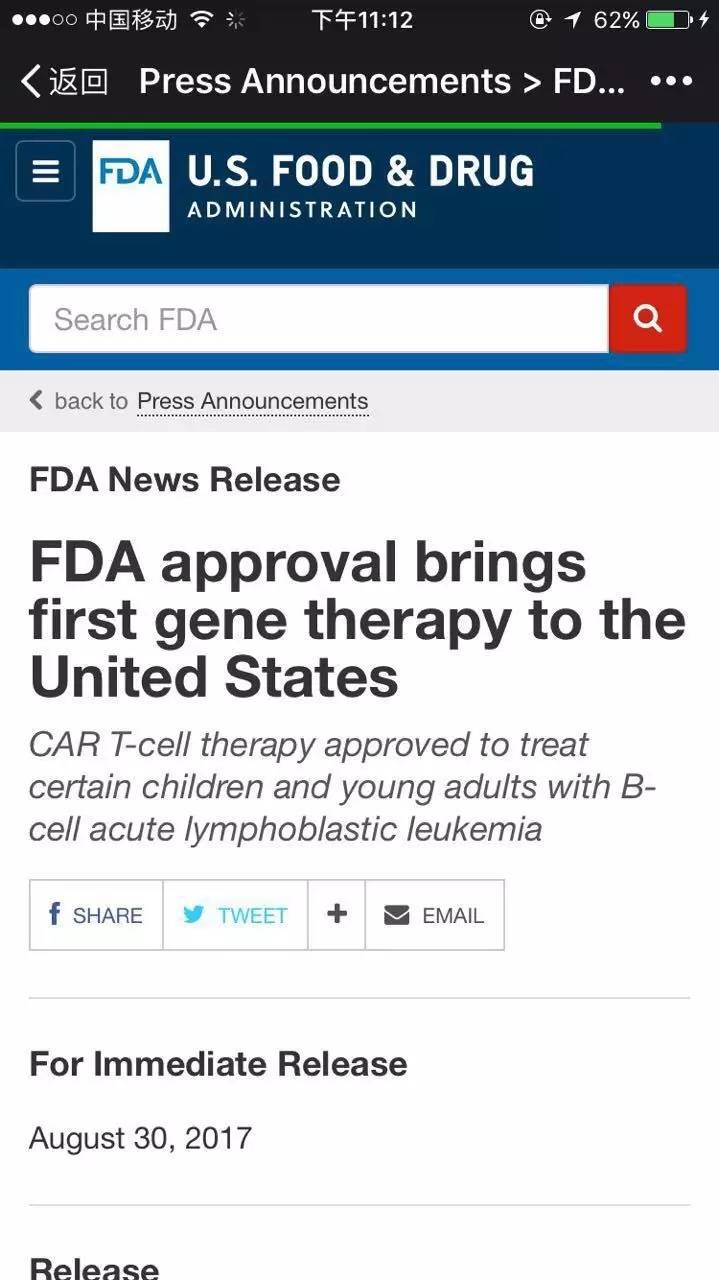
5 i2 Q) L3 P; }4 ? `3 S. m
# J! s! o+ R4 {' O0 Y. A$ ?
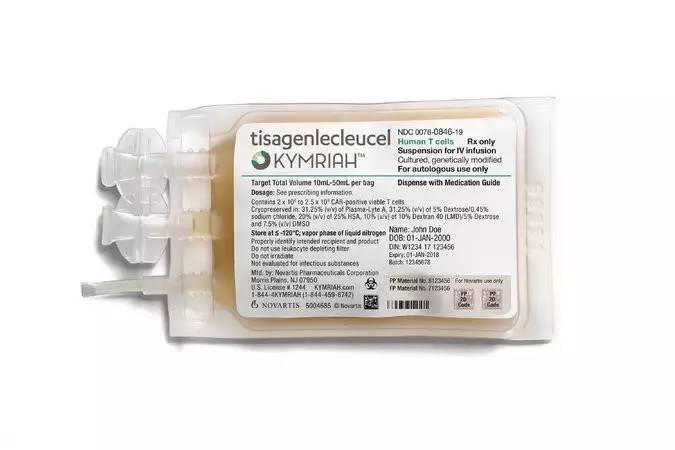
' k [3 R! K. e【中状元】2017年8月31日,媒体宣称美国FDA已经批准诺华公司CD19CAR-T疗法Tisagenlecleucel上市,用于治疗难治性B细胞前体急性淋巴性白血病(ALL),商品名为Kymriah。成为美国第一个基因治疗产品,各种刷屏!打鸡血!!! 4 @! E- Y1 I1 k" _
! o4 J( o2 {! F& U* g* C6 _
' }( X3 |" s/ s& d' G3 @
【西村老张问】隔壁老王买了小车(CAR-T),为啥邻里李大妈喜大普奔
2 n1 Y( _5 c# l) t& U
/ ~3 I. \2 g$ [7 a( ~1 ^/ v0 x* y q2 X2 B7 N

1 | i* }1 {+ Z. {8 ]$ V7 I! O; L
【乌龙1:状元郎弄错了】紧接着,有人指出诺华的CAR-T并非美国FDA“第一个细胞治疗产品” 那么,到底谁是真正的状元郎?
! m' Y( P9 g9 P% P9 E l. s 5 x( d; S2 N/ { R 5 x( d; S2 N/ { R
【状元1:今又生(重组人p53腺病毒注射液)】# B$ \0 x; E* q: w2 W& C
2003年由中国药监局批准的全球第一个基因疗法药物,用于多种癌症的治疗。被誉为"是基因研究和生物高技术领域新的里程碑"。事实上,世界范围内至少有58个“重组人p53腺病毒注射液”在大大小小的制药公司中立项研究,但是它们全都倒在了漫长临床试验的路上。今又生被认为是一个时代早产儿,为争第一而“抢跑”并“弯道超车”的产物,上市后曾被质疑缺乏有足够的临床试验数据来确证其抗癌效果,也成为了CFDA永久的伤疤,至“今”也没“又生”。
6 J& s. t8 e( h+ d d7 E, F7 n9 I& }# R' \

, v' `+ q4 t! }5 c6 E2 c1 N
【状元2:Provenge(Sipuleucel-T )】全球首个治疗性癌症疫苗,它由载有重组前列腺酸性磷酸酶(PAP)抗原的肿瘤患者自身的树突状细胞(免疫系统抗原的递呈细胞)构成。Provenge开发耗时近20年,2010年倍美国FDA上市,开创了癌症免疫治疗的新时代,它令罹患晚期前列腺癌的患者的平均存活时间延长了超过4个月。Provenge治疗一个病人开支为9.3万美元,疗法为一个月内三次注射。2015年原制造商Dendreon 公司宣告破产,2017年1月中国三胞公司以8.19亿美元接手Provenge。 9 Y4 k6 H# ^& m
1 c \4 }0 I* }: v- v
6 d' I& L# f' |) ^% ?( D3 @+ h) h【新科状元:Kymriah】的上市具有里程碑式的意义,CAR-T制备代表了细胞药物CMC的典范,Kymriah为个性化细胞药物杀开了一条血路,万里长征终于迈开第一步,值得生物医药领域同行的尊重与学习! 5 n# F; N8 X: W- z' t
5 w& G! Y3 p2 `0 k: Q9 E
& j8 v* E1 A2 g. O3 i" J# U
9 Y) ]9 i/ x5 R" n: J【东村老刘问】隔壁老王的儿子中了状元,邻里李大妈激动个啥?
4 P* I) f! M7 w) w! Q8 _, ~
2 X1 f M$ y2 _! e2 N
\ |' e N# u9 `& O6 l) P9 E+ H
f5 M6 @& V$ _, y: Z【乌龙2:用药剂量搞错了】中文媒体消息广为流传的Kymriah用法用量中,同样50kg上下体重细胞用量上限竟然相差50倍?不知哪个粗心大意的小编在50kg以上体重剂量总量上又加了“/kg”,使临床剂量在“1千万至2.5亿个T细胞”基础上又乘了50倍以上,原本CAR-T会引起强烈的“细胞因子风暴(CRS)和神经毒,如此这般疏忽会死人的!
8 m5 h, c* d, ]+ ` ) H: j/ w& A }9 W5 e% n: D; h ) H: j/ w& A }9 W5 e% n: D; h
【Kymriah官方说明书中用药剂量】
6 H; Q. ?! ~+ W& B9 |
* Y0 d/ L+ _; l$ p. \3 J% M: g/ W
, V$ l; N& W7 _; g7 D3 a5 a1 V
, G* a4 O* s4 y! @
【CD19一扫光】Kymriah单支售价折合人民币320万元二成为“富人续命的选择”,未来能否实现盈利不禁要画上一个大大问号?同时,CD19 CAR-T输注后一年内半数白血病患者复发,并且会清除接受者的体液免疫体系,患者次序终生注射免疫球蛋白维持生命,更让人怀疑的接受者的生殖系统可能也遭到了摧毁,祈祷可爱的小姑嫩Emily将来不会怀上死胎或怪胎吧!
& [3 Q% J/ G6 z- P
. ], O m3 a/ A: s. c1 @ ! U! d! h7 l9 {+ N& R' s7 W ! U! d! h7 l9 {+ N& R' s7 W
CMC (chemical manufacture control)——药物工艺质量开发 QbD (quality by design)——质量源于设计
【CAR-T一条街】
0 S- L3 g7 a: q# J希望Kymriah一路走好,全球已经批准了十四个细胞药物,迄今只有韩国的Cartistem实现了盈利。虽然CFDA尚未受理任何CAR-T新药注册申请,从资本追逐盛况看,国内有朝一日或许会形成“CAR-T一条街”的壮丽景观,但愿不会有价无市。+ M; k3 q* i' p) a6 x0 ~. K
/ e2 m6 P, D* O4 R& _# o1 X7 E
* g: D2 e9 R( k/ ~) b$ N/ y |