日志
干细胞2017年重要政策发布脉络
|
2017年重要政策发布脉络
01
1月12日国家发展改革委正式印发
《“十三五”生物产业发展规划》
文件中明确提出要培育符合国际规范的基因治疗、细胞治疗、免疫治疗等专业化服务平台,加快发展基因检测、细胞治疗、免疫治疗、基因编辑、产前筛查等多个热门领域,以推动个体化免疫细胞治疗的标准化和规范化,满足临床需求、维护公众健康、降低医疗成本,使我国在细胞治疗领域达到世界先进水平
02
1月24日科技部组织申报国家重点研发计划 “干细胞及转化研究”
通知表示,“干细胞及转化研究”等重点专项已完成2017年项目预评审,将进入正式申报书(含预算申报书)填报阶段。
03
3月16日6个国家干细胞临床研究
备案项目公开

国家卫生计生委和国家食品药品监管总局在“医学研究备案登记信息系统”中公布了首批通过备案的6个干细胞临床研究项目,我国干细胞临床试验正式步入正轨。
04
4月6日关于加强干细胞临床研究
备案与监管工作的通知
卫计委发布《通知》提出:认真组织开展第二批干细胞临床研究机构备案审核工作、督促已备案机构尽快进行干细胞临床研究项目备案、积极做好干细胞临床研究专项监督检查相关准备工作。
05
5月10日“十三五”生物技术
创新专项规划发布

规划明确,要紧紧围绕民生健康和新兴产业培育的战略需求,突出创新药物、医疗器械等重大产品研制和精准化、个体化、可替代或可再生为代表的未来医学发展。重点突破新型疫苗、抗体制备、免疫治疗等关键技术,抢占生物医药产业战略制高点,力争到2020年实现我国生物医药整体由“跟跑”到“并跑”、部分领域“领跑”的转变。
06
5月16日《“十三五”卫生与健康
科技创新专项规划》
国家科技部、国家卫计委、体育总局、食品药品监管总局、国家中医药管理局、中央军委后勤保障部等六部委联合印发《规划》,要求加强干细胞和再生医学、免疫治疗、基因治疗、细胞治疗等关键技术研究,加快生物治疗前沿技术的临床应用,创新治疗技术,提高临床救治水平。
07
5月24日干细胞及转化研究等重点专项
2018申报建议征求意见
科学技术部发布通知,对国家重点研发计划干细胞及转化研究等6个重点专项2018年度项目申报指南向社会征求意见和建议。2018年,国家重点研发计划的6个重点专项是:干细胞及转化研究、纳米科技、量子调控与量子信息、蛋白质机器与生命过程调控、大科学装置前沿研究、全球变化及应对。
08
5月31日《“十三五”国家
基础研究专项规划》

国家科技部、教育部、中国科学院、国家自然科学基金会联合发布《规划》,明确我国干细胞及转化研究以增强我国干细胞转化应用的核心竞争力为目标,以我国多发的神经、血液、心血管、生殖等系统和肝、肾、胰等器官的重大疾病治疗为需求牵引,重点部署多能干细胞建立与干性维持,组织干细胞获得、功能和调控,干细胞定向分化及细胞转分化,干细胞移植后体内功能建立与调控,基于干细胞的组织和器官功能再造,干细胞资源库,利用动物模型的干细胞临床前评估,干细胞临床研究。
09
6月1日“干细胞及转化研究”等
17年国家重点研发计划公示
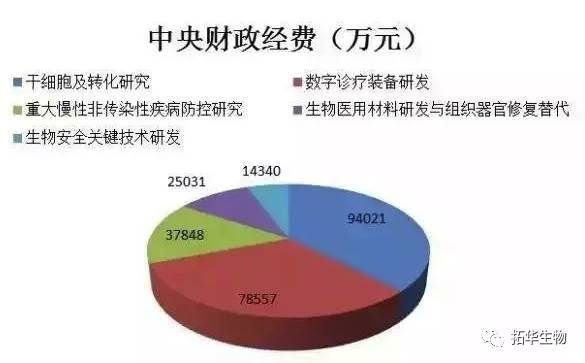
备受瞩目的“干细胞及转化研究”重点专项共计拟立项达43项,国拨经费数总计94021万元,其中获资助超过2000万元的项目达27个,在五大项目中占比最重。国家对干细胞及其转化研究的重视程度可见一斑。
10
6月6日《“十三五”卫生与
健康科技创新专项规划》

由国家科技部、国家卫生计生委、体育总局、食品药品监管总局、国家中医药管理局、中央军委后勤保障部等六部委联合印发《规划》,要求加强干细胞和再生医学、免疫治疗、基因治疗、细胞治疗等关键技术研究,加快生物治疗前沿技术的临床应用,创新治疗技术,提高临床救治水平。
11
9月19日首个干细胞通用标准
《细胞库质量管理规范》发布
中国医药生物技术协会发布公告,明确《细胞库质量管理规范》是参照《药品生产质量管理规范》(GMP)等相关规则和指导原则,经业内骨干企业及专家的研讨,为适应我国细胞库产业发展需要、加强细胞库质量管理、促进行业自律而制定。
规范内容包括:适用范围、规范性引用文件、术语和定义、基本要求、细胞库的质量标准、细胞入库、细胞冷冻与深低温保藏、细胞出库、标识管理与追溯等若干方面。
12
9月28日干细胞及转化研究试点
专项2018年度申报指南发布

科技部正式发布了15个重点专项2018年度项目申报指南。其中,“干细胞及转化研究”试点专项拟优先支持20个研究方向,国拨总经费6.3亿元。
13
11月22日首个干细胞通用标准
《干细胞通用要求》正式发行

《干细胞通用要求》是根据国家标准委2017年发布的《团体标准管理规定》制订的首个针对干细胞通用要求的规范性文件,将在规范干细胞行业发展,保障受试者权益,促进干细胞转化研究等方面发挥重要作用。
《要求》规定了干细胞术语和定义、分类、伦理、质量要求等六个部分的内容,围绕干细胞制剂的安全性、有效性及稳定性等关键问题,建立了干细胞的供者筛查、组织采集、细胞分离、培养、冻存及检测等通用要求。
14
11月28日第二批干细胞临床研究
备案机构名单公布
根据《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48号),国家卫生计生委和食品药品监管总局组织对申报干细胞临床研究机构备案材料进行复核,并于11月28日下发公告,公布第二批干细胞临床研究备案机构。此次共有72家机构通过审核。
可以说,2017年是细胞领域政策播种的一年,相信在2018,干细胞技术将承载政策和资本两大力量,实现新一轮的全面腾飞。
全部作者的其他最新日志
热门日志导读
- • 感受
- • 努力挣威望
- • “干细胞”滥用:救命还是敛财?
- • 慢慢体会的小故事
- • 细胞培养板的选择
- • miRNA-操纵干细胞命运




