|
 
- 积分
- 426
- 威望
- 426
- 包包
- 3526

|
医药网7月15日讯 未来,小分子药研发还能否保持主导地位?生物药能否取而代之?口服剂型更为便利,为什么2016年注射剂药物占比还在增加?靶标蛋白数量之于创新,意味着什么?本文就一些热点问题进行探讨。依然以Pharmaprojects/Pipeline数据为基础进行分析。6 U. ^( S% D3 v# ~
1小分子药 PK 生物药:小分子药仍然主导,但地位动摇
" H9 J% x% D' n! B& U( f0 M8 c: H) ]$ y. h
根据在研药物来源的不同,可将全球在研药物分为化学合成小分子药物、生物制品和天然来源药物三类,也可将这些类别进一步细分。
6 b$ F3 z% }- l% g3 H6 l9 D% z: ]: O+ a' r/ K2 _6 W h' q
对于行业在宏观层面是倾向于小分子药物还是生物制品发展这一问题,还是值得探讨的。
. m) B) D8 }4 W) m7 v7 y; y# Y8 l& O. o) S# D
虽然化学合成小分子药物的开发难度逐年增加,该类在研药物数量增长的可持续性存疑,但毫无疑问,化学合成小分子物质仍是候选药物的最主要来源,多年来该类药物占比均超过50%。未来一段时间内,化学合成的小分子药物仍将在新药研发物质来源方面占据主导地位,2016年该类药物数量增幅为11.3%,与全球在研药物数量增速基本相当。+ ?1 u9 H* V6 `3 _1 O U
: A( R" P! n% l- A! V- n
正如我们所看到的,小分子药物依然占据主导地位,但生物制品的增速亦不能小觑,至于其未来能否逐渐取代小分子药物的位置,目前尚不可知。通过对1995-2016年相关研究数据进行分析后发现,传统的新化学实体药物的地位正在动摇。
( x- M1 y, b6 n1 @) k4 O6 ^" H4 j! q1 K1 X- n+ h
生物制品自上世纪90年代出现,之后一直保持稳定增长,自2010年以来,虽然生物制品的发展在一定程度上得到了推动,但增长仍较为缓慢。而在过去的一年多时间中,生物制品得到了较为快速的发展。截至目前,生物制品在全球在研药物整体中的比例已超过33%,其跳跃式增长格外引人注意。从过去20多年的数据来看,目前在研生物制品的数量较1995年的数据几乎增长了一倍,表现还是值得肯定的。) t4 f1 q+ F9 b2 g9 C
$ a/ ]! S& @4 e
从在研药物数量增幅来看,单克隆抗体类药物数量增速相对较快,2016年其增幅高达15.7%。但是,最引人注目的药物类别还是细胞治疗药物。自体(增幅为25.9%)、异源(23.4%)和普通(110%)细胞疗法,其在研药物数量平均增速可达47.2%。从这些数据不难看出,与细胞疗法相关的药物可能会成为未来新药研发的明星产品。; x" k. X# d& U+ t/ N' x) N1 m I
' v' j% M6 W6 P, v6 n) [& {( m
2给药途径PK:在研注射剂占比增加, j7 B9 e- z1 {9 G
4 Y) T- f2 k& z0 S, J 从在研药物给药途径的相关数据来看,2016年在研药物给药途径排名居前五位的剂型包括注射剂(数量为4575)、口服药物(3181)、外用药(507)、吸入剂(393)和眼科用药(189)。
# e: N8 n& L& h
- G" o- p! Y/ K6 \ D7 g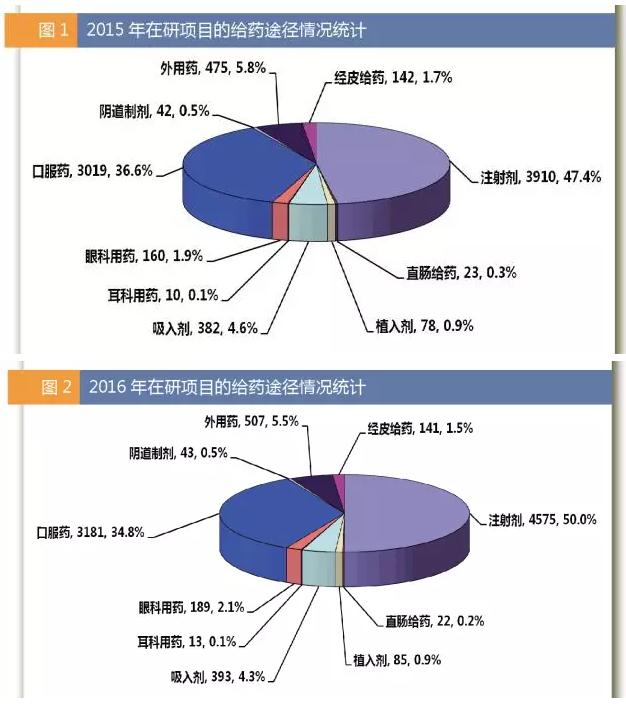
5 z$ I. D4 X7 s, i( r" _$ p! q4 p1 M6 t0 \" D
从市场占比来看,注射剂药品的占比已从2015年的47.4%增至50.0%,而口服制剂的占比略有下降,已从2015年的36.6%降至34.8%。2016年外用药(5.7% vs 5.5%)和吸入剂(4.6% vs 4.2%)的占比也出现了小幅下滑。
" b) ~. c' J3 r" @
6 g3 S9 b, p0 A9 {+ I. N 从数据来看,目前在研的注射剂药品要多于口服制剂。尽管对于多数患者和行业,口服给药途径均更为适宜,但是生物大分子药物一般都是通过注射途径给予,疗效和靶向性相对会更高一些,而生物制品的快速发展也使注射剂药物占比进一步提高。从吸入性胰岛素的市场接受度来看,至少从目前情况来看,没有哪种剂型比注射剂更适合作为生物大分子药物的给药剂型。
6 b* }! e' Z- y E' x- F
$ X/ V7 }; R5 w- Y' a; A 3作用机制PK:免疫肿瘤势头猛,有望出大成就
7 g; l1 e' z7 w# H& I. l& x9 i7 X: I
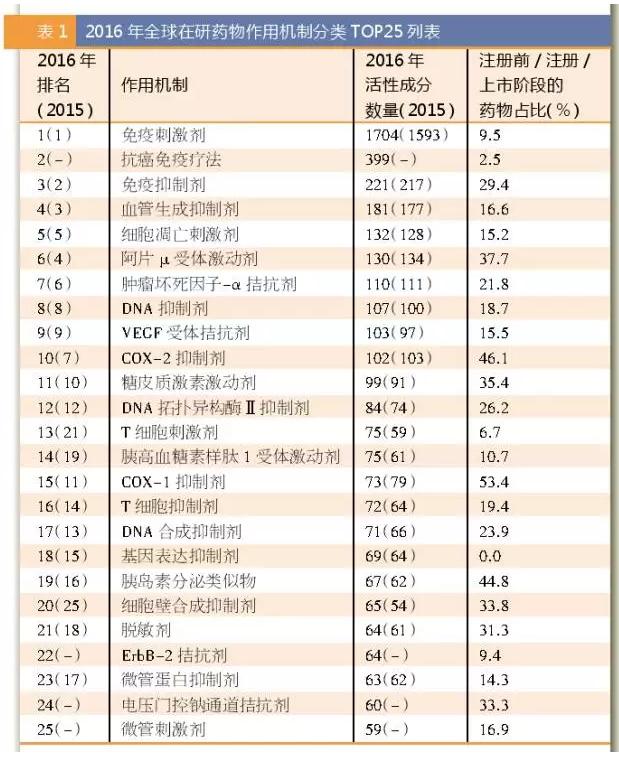
从在研药物的作用机制来看,目前排名居前五位的作用机制包括免疫刺激剂(1704个)、抗癌免疫疗法(399个)、免疫抑制剂(221个)、血管生成抑制剂(181个)和细胞凋亡刺激剂(132个)。通过对在研药物作用机制的分析,可使我们深入理解在研药物的开发策略以及新的疾病治疗方式。& }4 B0 v3 [$ E" j( T4 ~5 [% u8 n( l
- M" X' T& D) m
! {: c( X" z4 N9 a |
-
总评分: 威望 + 2
包包 + 10
查看全部评分
|