|

- 积分
- 1405
- 威望
- 1405
- 包包
- 7439

|
雪球今日话题 2015-03-09 20:36:00
% Y! O6 ]) s& r: ]
% r5 \' A( A7 m: H 3月5日,中源协和子公司和泽生物在食药监总局申报的治疗用生物制品新药--脐带间充质干细胞抗肝纤维化注射液(CXSL1200056)获得“在审批”阶段,表示中源协和干细胞药物获得突破性进展,见下图: 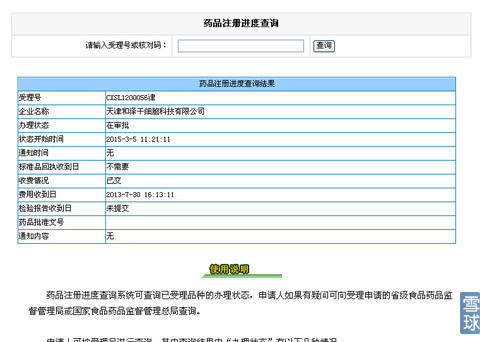
4 r$ m# v% i" E K3 g0 B 该事件预示国家干细胞制剂审批取得历史性进展,干细胞春天已经来临。 3 e! N" l8 C# U( {* [1 s8 U
一、事件揭示后续政策延续, ^/ t3 v) U; G
按照卫计委以前公布的干细胞3大政策征求意见稿--《干细胞临床试验研究管理办法(试行)》《干细胞临床试验研究基地管理办法(试行)》《干细胞制剂质量控制和临床前研究指导原则(试行)》,中源协和该类新药属于干细胞制剂,一旦获批预示即可在3年内进行3期临床和申报新药批号并投入使用。该3项规定目前看是卫计委和食药监联合发文,在这2会敏感时期,先有科技部率先发布《干细胞重点专项实施方案征求意见》,从产业专项角度进行产业扶持,后又由食药监悄悄放行中源协和的干细胞新药审批,揭示以下可能: ' Z) K9 @. ?% H5 E
预示干细胞政策即将出台,尤其按照新药注册相关程序规定:申请人可按受理号进行查询,其中查询结果中“办理状态”有以下几种情况: / [3 u3 a3 J8 N: Y
待审评:已受理,待国家食品药品监督管理总局技术审评部门审评。
+ Q" u l; Z% W. e6 ~ 在审评:在国家食品药品监督管理总局技术审评部门进行技术审评。
+ F9 I6 H b4 g1 @$ W/ ]& k B6 }& P 待审批:待国家食品药品监督管理总局审批。 ' \; ?% ?' \; H3 U. F
在审批:在国家食品药品监督管理总局进行审批。 ) I: ^0 ?" H v0 D
审批完毕-待制证:国家食品药品监督管理总局行政受理服务中心正在制作批件(国家药品标准颁布件由国家药典委员会制作)。 4 }% C- B. b% N' W7 m
制证完毕-待发批件:国家食品药品监督管理总局行政受理服务中心批件制作结束待送达(请关注“收费情况”)。
# K8 M2 Z1 z# C. I5 A' R 制证完毕-等待交回旧证:国家食品药品监督管理总局行政受理服务中心批件制作结束待申请人办理旧证换新证手续。 9 L! Q* _5 k6 o: M/ `0 b$ l
制证完毕-已发批件:批件已发给相应省级食品药品监督管理局注册处或进口药品申请人,可根据EMS号到11185网站查询邮寄过程。对多个申请人的,批件将同时发往各申请人所在地省级食品药品监督管理局,申请人可前往所在地省级食品药品监督管理局药品注册处领取。
Z$ V7 c% t! R: i, T- L: Z 已备案,备案结论:无异议:对于备案的补充申请结论,不再发放纸质批件。 ! F! w3 `* L8 k# b+ t. H. |
在上述流程中,在审批一般在20日内给出意见,除非经部长批准后可以延续10日,也就是30(工作)日内肝纤维化注射液就会有审批意见,个人判断,如果没有干细胞3办法出台,食药监不会提前做出如此高逼格的决定!
# p% u: d; w |4 T$ Q' p 二、对干细胞产业的整体冲击
! ?) z: M) B9 V$ `4 p8 X* p 中源协和治疗用生物制品新药--脐带间充质干细胞抗肝纤维化注射液一旦获批,即可进入临床许可,而我国干细胞临床审评自2009 年来一直处于停滞不前状态,该药一旦获得临床许可,个人预期2年内将会完成III期临床,按照国内乙肝携带者1亿人,肝纤维化患者约6-7000 万人,且目前治疗并无特效药的状态下,市场空间将是数十亿-上百亿,对干细胞治疗整个市场启动将是划时代的意义。
) g. U! n% Z% h3 t0 J: k/ U! z5 a( A 预期后续北科生物注射用人脐带间充质干细胞(红斑狼疮)等干细胞新药陆续由在审评进入在审批阶段,国内干细胞新药临床迎来百花齐放的阶段,因为因政策停滞6年之久的干细胞药物弯道超车欧美提供了机遇!
0 `1 `, w! n1 ~# z8 z 三、干细胞春天的野花绽放( i0 Q% x# B, o+ H- m
中源协和、北科生物、昂赛基因、通化天立、中国医学科学院基础医学研究所、地奥九泓、军事医学科学院附属医院等有干细胞新药申请的单位将迎来最绚烂的绽放! 1 g7 Y0 Z& K8 ]
|
-
总评分: 威望 + 2
包包 + 10
查看全部评分
|