日志
P53
|
如今,可以说没有哪个肿瘤研究领域里的研究人员不知道大名鼎鼎的p53蛋白,几乎每个人都能对p53蛋白与肿瘤的关系说出个一二三四。p53蛋白简直就是生物学领域里的“大腕”,在PubMed中,有关p53蛋白的文章就超过了5万篇,而且这个数字目前仍然以每周数篇的速度稳定增长。毫无疑问,由TP53基因编码的p53蛋白是生物学领域中研究热度最高的蛋白。世界上每两年就会举办一次国际p53蛋白研讨会(International p53 Workshop),来自全球的数百名科学家汇聚一堂,只为探讨这一个基因和蛋白。我们现在都知道,p53蛋白是人体内的主要抗癌蛋白,也是机体抵抗癌症的主要防线,但是我们当初对p53蛋白真实面目的了解过程却并非一帆风顺。在30年前第一次发现p53蛋白时,大家认为它不过只是一个新发现的蛋白而已,并没有人觉得它有多么的了不起,值得花费多大的精力和时间去研究它。p53蛋白与其它“表里如一”的癌蛋白不同,其它癌蛋白被发现之后马上就会成为研究的热点,但p53蛋白被发现之后却并没有受到多么大的关注。p53蛋白成为“大腕”的道路是一条充满艰辛与曲折的坎坷之路,大家对它的看法几经改变,有时甚至是完全将以往的结论推倒重来。透过p53蛋白30年来的发展史我们又一次看到了知识是如何发展、积累起来的;又一次看到了在科学发展史中屡屡出现的偶然事件的重要作用;看到了随着时代的发展,新的科研方法和技术的突破给科研带来的巨大推动作用。这30年来的科研历程还告诉我们,对一个基因和蛋白的深入研究也能够带给我们巨大的回报。
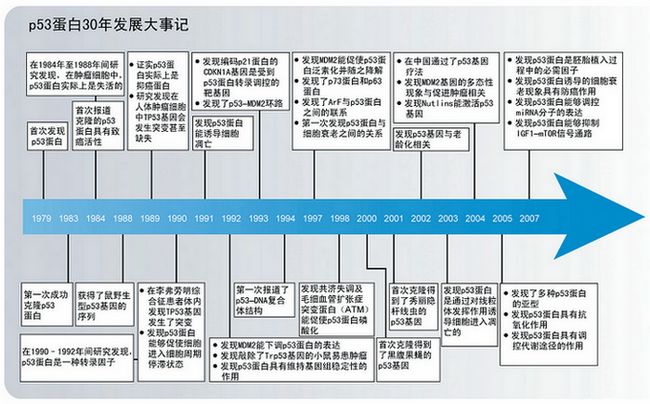
1. 病毒、癌蛋白和p53蛋白
在上世纪70年代,大部分肿瘤研究工作者的注意力都集中在致癌病毒研究领域。尤其是在发现很多病毒携带癌蛋白之后,大家的研究热情变得更为高涨。当时最大的成就就是第一次发现了RNA致癌病毒。研究表明,病毒可以“绑架”宿主细胞的基因,然后通过病毒感染将这个基因带入其它的细胞当中,这样,这个基因就会在宿主细胞中过表达,有时这些基因还会发生修饰,最终就可能导致宿主细胞发生转化。与此同时,科学家通过研究这些能够在动物体内过表达某些基因并诱使肿瘤发生的逆转录病毒基因组中基因整合位点附近的基因发现了很多癌基因。
之后的15年里,我们发现了很多癌基因,也知道了这些癌基因就是导致动物患上肿瘤的罪魁祸首。因此,我们自然而然地联想到DNA病毒也会通过同样的方式(即从宿主细胞中“窃取”癌基因或者自己编码癌基因)致使人或动物患上肿瘤。随即很快就发现DNA致癌病毒也携带有癌基因,不过这些癌基因和RNA致癌病毒里携带的癌基因不同,它们并不是宿主细胞来源的癌基因。那么这些病毒癌基因又是如何转换宿主细胞,致使肿瘤发生的呢?有人提出,这些由病毒编码的病毒癌基因可以间接导致宿主细胞癌基因过表达,从而导致癌症发生。正是基于这种理论,p53蛋白才第一次被发现。
动物试验中发现,很多小DNA病毒,例如猿猴空泡病毒40(simian virus 40, SV40)等都能致使动物患上肿瘤,而这些病毒自身编码的蛋白数量都非常少。这些病毒蛋白能够被动物的机体免疫系统所识别,诱导产生抗体中和这些病毒蛋白。到上世纪70年代中期,使用这些针对病毒蛋白的抗体来开展研究已经成为了非常常见的“流行”方法了。人们可以利用这些抗体来检测并监测病毒蛋白在转换细胞中的表达情况。由于大家使用的是这种以抗原与抗体反应为基础的检测方法,因此也就将被检测的病毒蛋白称为病毒致癌抗原(viral tumour antigen)。后来通过遗传学分析发现,编码这些病毒致癌抗原的基因就是那些编码病毒癌蛋白,致使宿主细胞发生转化的基因。比如在SV40病毒中,我们就通过这种抗原与抗体反应发现了两种病毒癌蛋白,分别被称为大T抗原(large T-antigen)和小T抗原(small T-antigen)。
1979年,在大家都在研究SV40病毒的癌蛋白时,好几个科研小组都无意中分别独立发现了p53蛋白。当时在英国皇家癌症研究基金(Imperial Cancer Research Fund),现名为伦敦癌症研究所(London Research Institute)工作的David Lane和Lionel Crawford发现,用感染了SV40病毒的动物血清与SV40大T抗原发生免疫沉淀反应时能共沉淀下来一个分子量约为53kDa的宿主细胞蛋白。进一步分析表明,这个宿主蛋白能够与SV40大T抗原形成复合物。因此我们得出结论,一直被认为具有宿主细胞转化作用,能够促使宿主形成肿瘤的SV40大T抗原,是通过一种直接的、特异性的相互作用“选择”了这个我们迄今为止仍然没能完全了解清楚的宿主细胞蛋白一起共同发挥作用的。与此同时,美国普林斯顿大学(Princeton University)的Daniel Linzer和Arnold Levine也使用类似的免疫方法得到了和David等人同样的结论。另外三个科研小组也都在1979年同时发表文章报道了同样的结论,他们分别是法国的Pierre May科研小组、美国纽约的Robert Carroll科研小组和英国的Alan Smith科研小组。
有意思的是,Linzer 和 Levine还发现用感染了SV40病毒的动物血清也能从畸胎瘤(teratocarcinoma)细胞中沉淀得到同样分子量为53 kDa的蛋白质,但是这些细胞并没有被SV40病毒感染。这说明这种动物血清中可能有一类抗体能够直接与这种分子量为53 kDa的蛋白质发生相互作用。Lloyd Old等人也发现,使用不是由病毒感染产生的转化细胞免疫动物后得到的血清,同样能够与这种分子量为53 kDa的蛋白质发生免疫反应。这些实验证据都表明,这种分子量为53 kDa的蛋白质就是一种细胞来源的肿瘤抗原。此外,在戴维•巴尔的摩实验室(laboratory of David Baltimore,戴维•巴尔的摩是美国生物学研究的领袖人物,上世纪70年代,巴尔的摩因发现肿瘤病毒与细胞遗传物质的相互作用,用新的分子生物学理论说明了肿瘤和艾滋病病毒破坏正常细胞的过程,这使他在1975年获得诺贝尔生理和医学奖,获奖时年仅37岁)工作的Varda Rotter也发现了这种分子量为53 kDa的蛋白质,他发现在感染了爱柏森鼠类白血病病毒(Abelson murine leukaemia virus)这种逆转录病毒后形成的转化细胞中,这种蛋白质的表达量大为增加。随后又发现在感染了SV40病毒的肿瘤细胞以及其它一些肿瘤细胞中这种分子量为53 kDa的蛋白质的表达量都明显增高,但是在非转化细胞中它们的表达量却很低,甚至不表达。
和其它很多同时被多个实验室发现的蛋白质一样,每个实验室也分别给这种分子量为53 kDa的蛋白质取了各自的名字,并且使用这些名字发表了很多论文,这样就造成极大的混乱。1983年在英国牛津举办的第一届国际p53蛋白研讨会上,来自各国的代表专门就这个蛋白的命名进行了讨论。经过一番激烈争论之后,大家一致认为,p53这个名字最为合适,自此被保留下来一直沿用至今(详见背景知识1)。
其实p53这个名字根本就不是一个名字,只是因为这个蛋白在SDS聚丙烯酰胺凝胶电泳试验中表现出的分子量大约为53 kDa才因此而得名。后来大家才发现,这个表观分子量其实也只是一个大概的估计,因为该蛋白富含脯氨酸,所以在SDS聚丙烯酰胺凝胶电泳试验中的迁移率偏慢,表现出来的分子量要比它实际的分子量大。该蛋白的实际分子量只有43.7 kDa,而小鼠体内p53蛋白的分子量会更小。但是谁又能够更改得了这个被大家使用已久的名字呢?
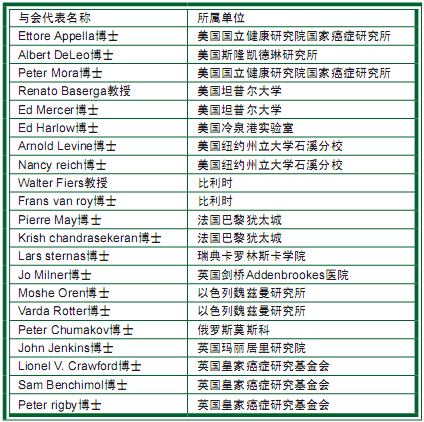
背景知识1:第一届国际p53蛋白研讨会
1983年5月7日至5月10日,在英国玛丽居里研究院(Marie Curie Research Institute)举办了第一届国际p53蛋白研讨会。整个会议议程并没有安排任何演讲报告,大家关注的最大热点就是第一次发表的鼠p53基因cDNA序列和有关人p53基因克隆工作的报告。下表中列举了与会代表,这些人几乎都是当年参与研究p53蛋白的科研工作者,不过有些重量级人物并没有列出,比如David Lane。本表资料由Varda Rotter提供。
2. 最初的观点:p53基因是一个癌基因吗?
正如前文所述,1979年时大家普遍认为逆转录病毒可以通过“劫持”细胞癌基因并使它们在感染细胞中以过表达的方式来促使感染细胞癌变。在这种理论背景之下,科研工作者观察到SV40病毒能促使被感染细胞大量表达p53蛋白。鉴于此,大家当然会认为p53基因是一个癌基因。但值得注意的是,有人发现有一种SV40病毒的温度敏感突变株的大T抗原能够以温度依赖的方式调控p53蛋白的表达水平,即在有大T抗原时p53蛋白表达增多,没有大T抗原时p53蛋白表达降低,这说明p53蛋白的含量与细胞转化之间具有正相关关系。这些现象都表明p53蛋白是一种癌蛋白。还有一些实验结论也支持这个观点。比如,Levine实验室的Peter Sarnow就发现了由一种小DNA病毒——腺病毒编码的分子量为55 kDa的肿瘤抗原E1B,也能与p53蛋白相结合并促使胞内p53蛋白大量积聚。另外,Rotter还发现很多肿瘤细胞内都会大量表达p53蛋白,但是在正常组织细胞中却观察不到这种现象。这些实验结果都支持了DeLeo等人的实验结果,即p53蛋白只会在转化细胞而不是非转化细胞中大量表达。
基于此结论,大家都开始将研究重点放在了研究p53蛋白的致癌作用方面。要进行这方面的研究首先必须获得p53基因,接着才能进行后续的体内、体外实验。于是,世界各地展开了一场p53基因克隆竞赛。当时世界上好几个实验室几乎同时都参加了这场竞赛。在上世纪80年代初,基因克隆技术还不像今天这么成熟,因此克隆一个基因也并非易事。实际上,在当时进行基因克隆操作是一项非常麻烦、极易出错的实验工作,需要花费很多时间、精力和智慧,还需要一些运气才能获得成功。不过最终有好几个实验室都取得了成功。随后又有人获得了小鼠和人p53基因的cDNA和基因组克隆。值得一提的是,当时基因克隆技术的成功率非常低,有人为此专门设计了一些方法来筛选p53蛋白表达量高的细胞。这些细胞中编码p53蛋白的mRNA分子含量比较高,有利于获得p53基因的克隆。由于p53蛋白在肿瘤细胞中的含量非常丰富,因此大家自然而然就会想到利用肿瘤细胞而不是正常组织的RNA来进行克隆操作,当然也有人成功了。这就决定了p53蛋白研究历程中最初10年的研究方向和结论。直到几年之后,大家才充分意识到这一点。
利用实验得到的p53克隆,科研工作者在各种实验中对p53蛋白过表达会促使细胞癌变这样一个观点进行了验证。当然结论令大家非常满意。John Jenkins实验室、Moshe Oren实验室、Rotter和Robert Weinberg实验室等都陆续发现p53基因和一些已经证明的癌基因,比如HRAS基因等转染细胞能够有效地转化体外培养的原代细胞。如果过表达p53蛋白会促使这些细胞永生化。在这些试验中,p53蛋白的作用就和MYC癌蛋白的作用一样。研究还发现,克隆的p53蛋白能增强现有细胞系的转化能力,相比p53-null细胞,转染了p53基因的细胞系在体内试验中表现出了更强的致癌性。总而言之,在上世纪80年代中期以前,大家普遍认为p53基因是一种癌基因,只是不清楚它的作用机制和各种功能。
3. 重新认识p53基因:p53基因是抑癌基因
数年之后,人们才对p53基因有了新的认识。大家发现p53基因其实并非癌基因。恰恰相反,它是抑癌基因。实际上,早就有各种线索显示p53基因可能是抑癌基因。回顾往事,第一条线索是由David Wolf和Rotter在1984年发现的。当时他们发现编码小鼠p53蛋白的Trp53基因如果借助逆转录病毒插入经爱柏森鼠类白血病病毒感染而转化的细胞系之后会失活。Sam Benchimol和Alan Bernstein等人在研究由弗里德红白血病病毒(Friend erythroleukaemia virus)诱发的小鼠白血病时也都观察到了类似的现象。另外,Rotter等人还发现Trp53基因重排的现象非常普遍,而且还发现在人白血病细胞系HL60细胞中Trp53基因的编码序列实际上是缺失的,因此HL60细胞根本无法表达p53蛋白。以上这些实验结果表明,缺失p53蛋白与癌症有关,意即p53蛋白应该是阻止癌症发生的。不过,在当时并没有得出这种结论。当时有大量明白无误的证据确凿表明p53蛋白是一种癌蛋白,所以大家都认为上述实验结果可能只是一些例外而已。当大多数人都持某一种观点时,哪怕有证据能够反驳这种观点,大家都会很容易无视这些证据的存在。
不过,当Levine实验室的Cathy Finlay和Phil Hinds得到了另一个p53 cDNA克隆结果时,大家再也无法无视反对的意见了。这是因为Cathy他们得到的克隆居然无法像早先试验中得到的克隆(比如Oren实验室得到的克隆)那样成功地转化细胞。于是,Cathy等人将多种p53基因的克隆序列进行了比对。结果他们惊奇地发现,竟然没有两个克隆的序列是一致的。这说明以前使用的p53克隆即使不是全部,但至少有部分克隆肯定是突变基因克隆。在与来自小鼠正常组织的野生型Trp53基因序列进行比对后更加验证了上述结论的正确性。现在人们明白到,利用鼠来源的肿瘤细胞系获得的p53基因克隆通常都是发生了突变的克隆,也只有这些突变的克隆才能在试验中表现出细胞转化活性。于是,大家开始意识到肿瘤细胞来源的p53基因突变体能够促使细胞发生转化,而野生型的p53基因则不具备这项功能。
那么,野生型p53基因与肿瘤之间又存在一种什么样的关系呢?经过对人体肿瘤组织样品DNA的深入研究以及各种体外功能性实验的研究,我们最终揭开了p53基因的真实面目。Bert Vogelstein等人研究发现,在人体结肠癌肿瘤细胞中,野生型的Trp53等位基因经常会因为发生突变或缺失而失活,也就是说肿瘤细胞里根本就无法表达正常的野生型p53蛋白,这也就意味着p53基因很有可能就是一个抑癌基因。与此同时,Levine和Oren也分别各自对p53基因展开了功能学研究。实验结果非常出人意料,与以往表达肿瘤细胞来源的p53基因结果不同,在细胞内过表达野生型的p53基因不仅不能使细胞转化,反而能够有效地抑制MYC基因和HRAS基因等这些癌基因对细胞施加的转化作用。综合早前观察到的小鼠肿瘤细胞和人体肿瘤细胞中p53蛋白缺失的现象,加之后来发现的因为p53基因有突变所导致的李弗劳明综合征以及Trp53基因敲除小鼠的表现等证据,大家一致认为p53基因一定是一个如假包换的抑癌基因。
后来没过多久人们就发现,TP53基因突变的现象不仅在结肠癌中非常常见,在其它各种人体常见肿瘤细胞中也是屡见不鲜。至少在某些种类的肿瘤细胞中TP53基因突变发生得比较晚,这可能意味着TP53基因突变与肿瘤的扩散有关。有人综合了数千项有关TP53基因的研究数据,结果发现TP53基因突变现象与我们目前已知的过半肿瘤都有关联。TP53基因毫无争议地成为人体肿瘤研究领域里关注度最高的一个基因,它也是人体肿瘤细胞中发生突变最频繁的一个基因。有关p53基因的专门数据库也已经建立,比如国际癌症研究会的TP53基因突变数据库(International Agency for Cancer Research TP53 Mutation Database)、TP53基因网站(TP53 Website)以及p53基因数据库(p53 Knowledgebase)等。这些数据库还是世界上第一个只为一个基因建立的数据库,它们的数据规模都非常大,一经建立就迅速成为p53基因研究领域和其它癌症研究领域里的重要资源。值得一提的是,在发现了野生型p53基因是抑癌基因以及它们在肿瘤细胞中经常表现为突变型这一真实情况之后,以前那些支持p53基因是癌基因的实验结果仍然可以得到圆满的解释。因为过去能得到这些“错误的”实验数据都是因为使用了来源于肿瘤细胞的“错误的”(突变的)TP53基因或TP53基因。这些突变体的确具有促癌作用,这可能是因为内源性的野生型p53基因显性负相失活或者是突变细胞真的获得了致癌活性。也就是说,野生型的p53基因的确是抑癌基因,突变型的p53基因的确是“癌基因”。
对于抑癌基因来说还必须符合两条标准,即携带有该基因突变型基因的人类个体应该表现出较高的癌变倾向;在动物实验中如果动物缺失该基因,也应该表现出较高的癌变倾向。不出所料,p53基因完全符合上述两条标准。实际上,p53基因突变就是李弗劳明综合征的致病原因。另外,最早由Donehower等人于1992年构建的Trp53基因敲除小鼠也极易患上肿瘤(主要是淋巴瘤)。
对p53基因的重新认识促使我们认真思考DNA致瘤病毒的病毒癌基因是如何发挥致瘤作用的。研究发现,SV40 T抗原和各种不同血清型腺病毒的E1A蛋白能够与视网膜母细胞瘤蛋白RB蛋白相结合,激活E2f转录因子,促使细胞进入S期。小DNA致瘤病毒通过这种方式能够获取它们自身复制所需要的各种酶和底物。不过,细胞通过这种不寻常的方式进入S期会被p53蛋白侦测到,随即p53蛋白会诱导细胞凋亡,以阻止病毒复制。但是病毒也不会束手待毙,它们会通过大T抗原或E1B蛋白等病毒蛋白与p53蛋白相结合的方式来抑制p53蛋白的抑癌作用。这种情况就和人体肿瘤细胞中的p53基因发生突变时一样。因此,病毒转化细胞中失活的p53蛋白大量积聚。重要的是,还有一些DNA致瘤病毒,比如包括有能诱发宫颈癌的HPV16和HPV18病毒的人乳头瘤病毒属(human papillomaviruses)病毒也能表达两种病毒蛋白——E7和E6。E7蛋白能与RB蛋白相结合,激活E2f信号通路;E6蛋白能和p53蛋白相结合,促进其降解、失活。此处,还需要提及的是HPV E6蛋白帮助我们发现了p53蛋白的泛素化降解调节途径。
在20世纪最后10年的头几年里,p53基因成为了最受瞩目的抑癌基因,也成为了全球研究的焦点,这股热潮一直延续至今。
4. p53基因是如何发挥作用的?
认识到p53蛋白在DNA致瘤病毒生活周期和人体肿瘤细胞周期中所发挥的重要作用之后,大家开始对p53蛋白的作用机制展开了研究。

4.1 p53蛋白的生物学活性
我们是在已转化细胞里重建了p53蛋白的正常功能之后,才对p53蛋白的生物学活性有了真正的了解。由于20世纪80年代末90年代初基因操作技术的发展突飞猛进,我们才建立了多种方法可以在细胞内重建p53蛋白的功能。其中有一个应用非常广泛的系统就是p53基因温度敏感突变体。这个突变体是在一次试验中由于培养箱的温度设置错误而偶然获得的。在培养温度为32℃时,该突变体具有野生型p53基因的活性,但是当培养温度上升至37℃及以上时,它就会失活。利用该突变体大家发现,重建野生型p53基因的活性之后能够使细胞生长停滞,既可以停滞在G1期,也可以停滞在G2/M期。利用其它一些方法也可以得到类似的结论。值得注意的是,在其它一些已转化细胞,比如M1白血病细胞里,重建p53基因的活性后会得到比较惊人的不同结果——几天之内所有细胞全部死亡。经过进一步的观察,人们发现所有细胞都表现出凋亡的典型特征。该研究结果与Shaw等人获得的类似研究结果一起表明,p53蛋白也是介导细胞凋亡的一个重要因子,同时也表明,p53蛋白可能是通过介导细胞凋亡来发挥抑癌作用的。最近,人们又发现p53蛋白可以诱导细胞老化,这已经成为它发挥抑癌作用的一大主要机制。不过无论如何,诱导细胞凋亡还是衰老最终都是阻止细胞恶变。综上所述,不论p53蛋白发挥何种作用,它都能阻止正常细胞演变成肿瘤细胞。
4.2 p53蛋白作用的分子机制
对于p53蛋白的生理作用我们已经研究得很多了,也积累了不少的资料,对此不再赘述。p53蛋白作为一个蛋白的最突出特点就是它是一个转录因子。好些研究都发现p53蛋白含有一个反式激活结构域(transactivation domain,但我们现在知道其实是有两个反式激活结构域),p53蛋白可以通过这些结构域与某一段特定的DNA序列紧密结合。是否具有这种直接与DNA结合并激活临近基因转录的特点是野生型p53蛋白和其它具有“致癌”作用的突变型蛋白之间的差别。
上述这些研究第一次发现了p53蛋白保守的结合序列,这样我们就能籍此对全基因组进行搜索,找出所有p53蛋白的潜在结合位点。这些实验证据表明,p53蛋白是一个序列特异性的转录因子。
我们发现了很多p53蛋白的靶基因。p53蛋白通过与这些基因内部或上游的p53反应元件相结合的方式反式激活这些基因的转录。这些靶基因中有很多都与细胞凋亡或细胞周期调控过程有关,比如编码细胞周期依赖性蛋白激酶抑制蛋白的p21基因和凋亡前体蛋白BAX的编码基因等。因此也就能够解释为什么p53基因活化后能够促进细胞死亡或生长停滞。还值得一提的是,世界上第一个用来检验能受到某些可诱导的特定(比如DNA损伤事件)转录因子调控的基因表达情况的芯片就是使用p53蛋白来作为检测靶标的。我们现在仍然在继续开展研究,期望弄清楚p53蛋白面对众多刺激信号是如何做出反应的。同时也在继续寻找其它的p53靶基因,这些靶基因中有很多都是细胞特异性或者是阶段特异性的。最近,人们又发现microRNA也是受到p53调控的底物之一,其中最重要的就是miR-34家族成员。由此看来,这份p53调控靶点的名单似乎永远也写不完。与此同时,研究还发现p53蛋白也能起到抑制转录的作用。p53蛋白可以通过多种不同的作用方式来达到抑制基因转录的目的,不过几乎没有通过直接与DNA相结合这种方式来发挥抑制作用的。p53蛋白能够同时调控数百个基因的转录活性足以说明它为什么能对细胞产生如此巨大的影响作用。
后来又发现p53蛋白也能起到转录因子之外的作用。这些非转录因子的作用也是多种多样的,不仅有胞内的作用,也有胞质中的作用。这些非转录因子作用中最值得一提的就是p53蛋白能够与胞质中的Bcl2家族蛋白发生相互作用,从而介导凋亡途径,使得线粒体外膜通透性增高,释放出细胞色素C,使细胞发生凋亡。不过,这些非转录因子的作用不是本文介绍的重点。
4.3 p53-MDM2环路
要研究某个蛋白的生化活性有一种最为常用的方法,那就是寻找能够与该蛋白发生相互作用的其它蛋白。这个方法在p53蛋白的研究当中被应用得最为广泛,也找到了非常多的能够与p53蛋白发生相互作用的其它蛋白。p53蛋白也是第一个被用于酵母双杂交筛查实验的哺乳动物蛋白。经过酵母双杂交实验也发现了两个新的能够与p53蛋白发生相互作用的蛋白——53BP1和53BP2,不过我们至今还不清楚它们的功能。
迄今为止,在众多p53蛋白的“伴侣”蛋白中最为著名,也最为重要的蛋白就是在1992年发现的MDM2蛋白。研究发现,MDM2蛋白能够与p53蛋白紧密结合,并抑制其生物学活性。从那以后,MDM2蛋白(人体的MDM2蛋白也被称为HDM2蛋白)就被认为可能是最重要的p53蛋白调控因子,并且是最有效的p53蛋白的“把关人”。MDM2蛋白可以通过多种方式抑制p53蛋白的作用。比如,它可以与p53蛋白的反式激活结构域相结合并抑制其活性。另外,MDM2蛋白还能起到E3泛素连接酶的作用,特异性地催化p53蛋白经泛素化途径降解。
后来的研究又发现MDM2基因居然是受p53蛋白调控的靶基因。p53蛋白和MDM2蛋白之间形成了一个负反馈环路。p53蛋白诱导MDM2蛋白表达,然后MDM2蛋白促进p53蛋白降解,从而限制胞内p53蛋白活性。经过多年的深入研究,我们了解到在非应激细胞中,p53蛋白的活性一直维持在一个较低的基础水平。这主要得益于p53–MDM2负反馈环路的作用。不过,在细胞受到各种应激信号的刺激时,p53蛋白就会迅速被激活。最早发现p53蛋白的这种可诱导特性的是Warren Maltzman,他发现细胞经紫外线照射后,胞内p53蛋白的含量会升高。随后,Michael Kastan得到的实验结果也进一步证实了Warren的结论。在这些实验数据的支持下,p53蛋白当之无愧地被誉为“细胞基因组的卫兵”。后来的研究也进一步证实了这个观点。p53蛋白具有的这种能够被应激信号所激活的开关是p53蛋白发挥各种抑癌作用的关键(图1)。MDM2蛋白就是控制这个开关的主要调控因子,MDM2蛋白能够保证p53蛋白不会被错误激活。当细胞面临各种致瘤刺激信号时,MDM2蛋白的含量就会减少,抑制作用就会被取消,p53蛋白就会被活化(图1)。Chuck Sherr等人的研究结果就支持了上述观点。他们发现ARF这种抑癌因子主要就是通过与MDM2蛋白相结合,从而“解放”p53蛋白,使p53蛋白发挥抑癌作用。
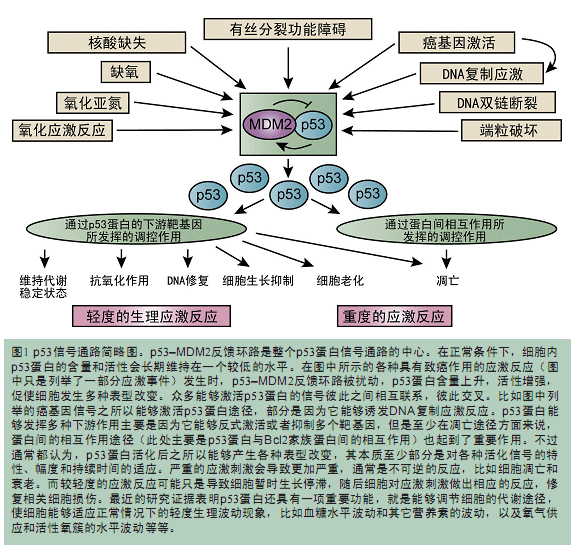
1996年,MDM2蛋白家族又“诞生了”一名新成员——MDMX,又名MDM4。MDMX蛋白与MDM2蛋白一样,也能与p53蛋白的N末端相结合,并抑制其活性。虽然没有发现MDMX蛋白具备E3连接酶活性,但是它也能够促进p53蛋白的降解。MDM2蛋白与MDMX蛋白形成二聚体之后能够增强其E3连接酶的活性。而且在小鼠试验中还发现,如果抑制MDM2蛋白或者MDMX蛋白的活性就会促使胚胎在较早时期夭折,这主要就是因为p53蛋白的活性没有受到约束。但是,如果同时敲除掉p53基因,那么胚胎就不会夭折了,这说明MDM2蛋白和MDMX蛋白都是p53蛋白的重要调控因子。根据上述结论我们不难得出这样的推论:如果过量表达MDMX蛋白那么就会导致癌症发生,就好像过量表达MDM2蛋白一样。后来的研究又发现了一个MDM2基因SNP位点,这更进一步突出了MDM2–p53环路的临床意义。因为携带某一种MDM2等位基因的个体会表达大量的MDM2蛋白,因而更易较早地罹患癌症。这也说明p53蛋白活性哪怕只是发生了一点点的改变也足以改变一个人罹患肿瘤的风险。虽然有大量的独立研究表明,这个SNP位点与癌症有着明显的关联,但同时也有一些实验结果不支持这个观点,尤其是有关乳腺癌的研究结果。这可能是由于这个SNP位点能够与绝经前妇女的雌激素受体(ER)共同发挥作用,因此无法利用关联分析将雌激素阳性患者和雌激素阴性患者区分开来,也就无法真正评价SNP对乳腺癌的作用。
MDM2–p53负反馈环路自然而然也成为了众多系统生物学家和计算机生物学家关注的热点。该环路已经成为研究信号通路内调控途径的经典模型。在实用研究领域该环路也是众多大有希望的抗癌药物的作用靶点。自从该环路被发现之后,我们又发现了其它许多有p53蛋白参与的反馈调控环路,而且这些调控途径的数量还在不断增加,这进一步说明p53蛋白拥有一个网络化的调控系统。
4.4 p53与癌症治疗
p53蛋白在人体肿瘤当中所具有的重要作用,理所当然地使它成为了癌症治疗研究当中大家共同关注的靶点。因此这么多年针对p53开展了无数的研究也就不足为奇了。不论是医药企业还是科研界都开发出了众多以p53为基础的抗癌药物和疗法。不过要想获得成功也绝非易事,p53蛋白既不是细胞表面蛋白也不是典型意义上的酶蛋白,因为我们无法针对p53蛋白开发近来非常流行,疗效也非常好的抗体类药物和小分子量的酶抑制剂类药物,只能另谋良策。
4.4.1 p53基因疗法
大家最初都主要将注意力放到了各种各样的基因疗法上,其中最直接的方法就是将p53基因导入癌症患者体内。实际上,世界各地有好多机构都曾经开展过这方面的研究,其中美国Introgen Therapeutics公司曾经在1996年得到过非常好的临床实验结果。
虽然这类实验开展得最早,但是它们获得最终成功并进入临床却来得非常晚。直到2004年,使用腺病毒载体治疗头颈部肿瘤的p53基因疗法才在中国获得批准,这也是迄今为止第一个获批的能够常规用于人体临床治疗的基因治疗方法。但是我们仍然需要时间对这种疗法做出最终的抉择。与此同时,众多的患者和科学家也都在热切期盼Introgen Therapeutics公司开发的新型腺病毒p53基因治疗产品Advexin的III期临床实验结果。
美国Onyx公司的McCormick等人也开发出了一种基因治疗方法,不过他们使用的仍然是重组腺病毒。不同的是,他们不是往细胞内转染TP53基因,而是使用了一种缺失了E1B蛋白(E1B蛋白能够与p53蛋白结合并使其失活,同时自身得以复制)的重组病毒。因此这种新型的溶瘤病毒被注入患者体内之后,能够在缺乏正常p53蛋白的肿瘤细胞内复制,杀灭肿瘤细胞。但是,由于这种溶瘤病毒缺失E1B蛋白,所以不会对正常细胞产生伤害。虽然该产品在临床实验中的结果非常好,但是要获批进入临床治疗还需要进一步评估。与此同时,另一种作用机制类似的相关溶瘤病毒也已经在中国获得了批准,可以用于癌症治疗。只有今后的临床实践才能告诉我们这种p53基因疗法是否真的能产生我们预期的抗癌疗效。
4.4.2 重建p53蛋白的活性
还有一种完全不同的方法就是开发出一种能够在肿瘤细胞内重建p53蛋白功能的小分子量复合物类药物。其中有一种策略就是开发出一种小分子物质,通过它可以与肿瘤细胞内突变的p53蛋白发生相互作用,促使该突变蛋白改变构象,恢复其正常功能。该类药物的代表——PRIMA1的临床实验结果将在近几年之内得到。这类药物可以用于携带有p53突变基因的患者,从理论上来说,这类患者的数量在所有肿瘤患者当中占到了50%。
第二种方法就是针对剩下的那一半患者了。这一部分患者并没有发生p53基因突变。目前已经开发出了能够破坏MDM2–p53间相互作用的药物,这样就能释放出p53蛋白,恢复其活性。其中最为成功的结果是美国Hoffmann-La Roche公司的研究团队获得的。随后,就诞生了大名鼎鼎的Nutlin。Nutlin能够与MDM2蛋白的p53结合结构域发生相互作用,有效促使p53蛋白与MDM2蛋白解离。它在动物实验中能够有效缩小肿瘤体积。与Nutlin法互补的方法就是小分子抑制剂RITA,即激活p53蛋白诱导肿瘤细胞凋亡(RITA)的小分子抑制剂。与Nutlin不同,RITA能够与p53蛋白相结合,抑制p53蛋白与MDM2蛋白间的相互作用。RITA的效果肯定很好,因为它对肿瘤细胞具有非常强的促凋亡杀灭作用,这一点比Nutlin更好。不过,我们现在还无法判断Nutlins和RITA或者最近才出现的针对p53蛋白与MDMX蛋白间相互作用的药物中究竟谁能够最终走向临床。尽管目前还不能应用于临床治疗,但是这些药物都已经成为了非常常用的研究手段,它们已经是研究工作中最常用的p53蛋白激活剂,而且是一种非常“干净”(特异性)的激动剂,它们不会给细胞造成非常广泛的应激刺激。这些药物最适用于大量表达MDM2蛋白的肿瘤患者。还有一些其它的化合物能够促进MDM2蛋白的降解,或者抑制MDM2蛋白的作用。我们相信,很快就会有新的基于p53蛋白的药物出现。
4.4.3 预后
我们发现p53蛋白在很多临床上常规使用的化疗药物——DNA损伤剂引发的细胞杀伤作用中起到关键作用这一现象之后,就想到是否可以利用TP53基因是否发生突变来判断药物的治疗效果以及患者的预后情况。不过,我们的这一设想还没有变成现实,这也反映了基因的复杂本质和每位肿瘤患者个体的多样性情况。同时,还因为TP53基因没有发生突变时,p53信号通路也经常会失活。但是的确有报道表明TP53基因的状态能够预测患者的预后。如果我们能够对各类肿瘤进行更好、更细致的分类,对各种患者也能进行更细致的分类,那么TP53基因一定会在癌症患者预后判断工作中发挥更加重要的作用。
5. 前景展望
再过10年,p53蛋白能给我们带来些什么呢?当然我们肯定需要弄清楚各种p53蛋白亚型在器官和个体发育中的作用。我们现在已经有了一点头绪,那就是p53蛋白、p63蛋白和p73蛋白(详见背景知识2)之间的比例关系,它们之间的作用是彼此拮抗的,有的是转录促进因子,有的又是转录抑制因子,但是它们对于细胞功能来说都是必不可少的。当然还有一些其它的线索帮助我们深入研究,比如p53蛋白单体或者二聚体能够和p63蛋白或p73蛋白一起形成异源四聚体(heterotetramers)。这三种转录因子结合在一起或许能够产生一种新的作用,使得p53蛋白的功能更加复杂多样。
更为复杂的是,p53蛋白(包括各种亚型蛋白)还能发生多种翻译后修饰,比如磷酸化、乙酰化、甲基化、泛素化、苏素化、类泛素化以及N乙醯葡萄糖胺(N-acetyl glucosamine)等。在细胞面临各种应激刺激信号或者发生某些生理改变时,p53蛋白会发生各种相应的翻译后修饰,因此我们认为这些翻译后的修饰机制对于p53蛋白的功能也具有非常重要的作用,但是目前还缺乏实验依据。比如,WIP1磷酸酶(又名PPM1D)是一种癌蛋白,它在多种肿瘤细胞中都会大量表达,它在p53蛋白上游发挥作用,能够使共济失调性毛细血管扩张症突变激酶(ATM)失活,阻止MEK对p53蛋白的磷酸化修饰作用,这样就能使胞内野生型p53蛋白失活,因此也说明了这些翻译后修饰机制的重要意义。也许在这个10年里我们有望看到WIP1蛋白抑制剂的临床实验结果。
虽然体外培养细胞的实验结果表明这些翻译后修饰机制具有非常重要的作用,但是对Trp53突变基因敲入小鼠进行研究的结果似乎又不能支持上述观点。究竟这些翻译后修饰机制起何种作用,这将是我们在这10年里研究的一大重点。
对于果蝇、线形动物、斑马鱼、小鼠乃至人体发育的研究将有望解决上述翻译后修饰的问题,也有可能阐明p53蛋白各个亚型的功能。已经有研究表明p53蛋白、p63蛋白和p73蛋白在女性生育系统发育、女性生殖细胞基因组稳定性维持方面具有重要作用。因此我们有信心,在下一个10年里我们一定能够弄清楚p53家族的作用。p53家族的这种性别差异作用(Sexual dimorphism,即只对女性有作用,对男性没有作用)可能部分是因为p53蛋白的靶基因,比如MDM2基因、LIF基因、WIP1基因等同时也受到雌激素和雌激素受体的调控作用。在各种应激刺激下,各种受雄性激素调控的基因以及其它核受体和配体可能也在p53信号通路中发挥了作用。
在这个10年里,我们还将对p53蛋白在代谢、生殖、生育、生殖细胞基因组失稳、肿瘤、生物寿命等众多领域里的作用进行更深入的研究。同时也将利用TP53基因的突变情况来判断患者的预后情况,开发新的治疗药物,以及选择合适的治疗方案等。除了肿瘤之外,p53蛋白可能还在一些其它的疾病当中发挥了重要作用。一定会有更多更大的惊喜在等着我们。如果说这头30年里我们有什么收获的话,那就是通过我们的努力,使得本来无法想到甚至猜到的理论、机制能够有望在下一个十年里阐明。我们今天所认同的一些观点在将来一定会得到一些修正。我们已经研究了30年的这个基因到了2019年一定会告诉我们更多东西,但同时肯定会带给我们更多问题,让我们更加困惑。
背景知识2:p53蛋白大家族
在相当长的一段时间里,大家都认为p53蛋白没有其它“亲戚”。直到发现了p53家族另外两位成员——p63蛋白和p73蛋白后,大家才意识到以前的看法是错误的。p63蛋白和p73蛋白在机体发育,比如皮肤发育、神经系统发育以及女性生殖系统发育过程中都起到了非常重要的作用,在某些情况下也能起到抑癌蛋白的作用。有意思的是,p53蛋白、p63蛋白和p73蛋白都含有一个非常相似的DNA结合结构域,都能与同一段DNA序列相结合,诱导某些相同的基因转录。但是,在某些细胞里它们又会诱导不同的基因转录。
另外,p53蛋白也并非一个单一的蛋白。经过近几年的研究我们逐渐发现,TP53基因可以经由广泛的可变剪接以及改变转录起始位点等方式表达出9种不同的p53蛋白亚型。这些亚型蛋白的主要区别在于蛋白的N端和C端不同。值得注意的是,如果p53蛋白缺失了N末端,那么对于其靶基因来说就会成为显性负相抑制子。有一些p53亚型蛋白会在不同组织的不同发育阶段出现。对于p53蛋白家族中这些新近发现的成员的具体作用我们还不得而知,但是随着它们真实面目的逐步揭开,我们相信p53蛋白将会迎来新的辉煌。
原文检索:
Arnold J. Levine and Moshe Oren. (2009) The first 30 years of p53: growing ever more complex. Nature Reviews Cancer, 9:749-757.
筱玥/编译
进化模式表明,最初的p53基因是先于肿瘤出现的。由于野生型p53基因具有肿瘤抑制功能而突变型p53基因又具有致瘤功能,因此p53基因名声大噪。这种双向功能可能是由与肿瘤无关的原始事件共选择造成的。我们可能能够推测出这些早期功能是从何而来的,了解这些知识有助于我们开发出新的治疗方法和药物。
在大约50%的肿瘤患者人群中都会发现p53基因突变的情况,这几乎已经成为了肿瘤研究领域里众人皆知的常识,但大家好像都对这种现象习以为常了,反而忽略了这样一个问题,为什么p53基因会有这么高的突变率呢?野生型的p53基因在应激反应网络中起到了举重轻重的作用,此时p53基因主要表现的是它的适应性反应功能,从而限制了它的致瘤作用。当细胞接受基因毒性物质、放射线损伤、缺氧或其它损伤信号时,p53蛋白会使细胞周期停滞,阻止细胞继续生长,促使DNA修复、细胞老化或者凋亡。与传统肿瘤抑制基因的突变方式(这些基因主要发生的都是无意突变或者框移突变)不同,至少80%的突变p53基因发生的是错意突变。这些突变体能够编码与野生型p53基因完全不同的致瘤因子,也会编码出显性负相突变体。但是尽管经过了大量研究,我们仍然不清楚这些突变体为什么能够转化细胞。因此,虽然众多的论文都在试图解释p53基因是如何发挥正常功能的,但是关于p53基因突变体是如何形成致瘤作用的仍然存在争议。为什么在肿瘤细胞中p53基因突变现象会如此多见呢?是否存在某些性质参与了p53基因或p53蛋白具有这一特别活性的形成呢?或者p53蛋白是否只是一个普通的蛋白,只不过它碰巧在胞内复杂的调控网络中占据了重要的限速位置呢?本文我们将从进化的角度对上述问题以及其它相关问题进行讨论。首先,我们将回顾一下这个古老基因家族的进化历程,从中发掘出最新的基因序列信息以及模式系统研究信息。然后,我们将p53调控网络的基本特点与衍生特点进行比较,看看这样是否能发现一些与肿瘤相关的新线索。
1. p53的祖先
目前在人体中已经发现了三个p53家族成员,它们分别是p53、p63和p73。正如图1所示,这三个家族成员都含有一个氨基末端的反式激活结构域、一个中间DNA结合结构域以及一个羧基末端的寡聚化结构域。其中反式激活结构域和寡聚化结构域似乎变异程度比较大,而DNA结合结构域则比较保守。值得注意的是,在p63蛋白和p73蛋白的C末端均含有一个不育α基序(SAM)。这个基序的作用可能是促进蛋白间的相互作用。对于p73蛋白来说,该基序还与蛋白的转归有关。不过,p53蛋白不含该SAM基序。因此,单从蛋白结构上来说,p63蛋白与p73蛋白可能源自同一个“近代”祖先。根据目前掌握的信息,我们还无法弄清楚各个p53亚家族之间的进化关系。为了简化问题,我们在此只考虑各种全长序列的异构体。我们将p53家族中编码SAM基序的蛋白统称为p63和p73样蛋白,将缺乏SAM基序的统称为p53样蛋白。

1.1 新的基因组数据发掘出了更古老的祖先
p53家族成员广泛分布于各种动物体内,包括许多无脊椎动物,比如海鞘类动物(ascidians,sea squirts)、刺胞动物(cnidarians)、扁形动物(platyhelminths)及其它一些无脊椎动物(图1)。因为酵母基因组中不含p53基因,所以早期的传统观点认为p53基因家族起源于动物界。这可能是早期多细胞生物为了应对选择压力进化而来的。不过,最近公布的单细胞原生动物领鞭毛虫(choanoflagellate, Monosiga brevicollis)的基因组数据打破了上述观点。在领鞭毛虫的基因组中既包含有p53样序列,也包含有p63、p73样序列。同样,我们在另一种原生动物——阿米巴原虫(amoeba, Entamoeba histolytica)中也发现了p53样蛋白。这些发现使我们需至少从两个方面对以前的p53进化树做出修订。首先,p53基因家族的出现时间必须提前,应该是在多细胞动物出现之前就已经出现了;其次,p53样基因与p63及p73样基因可能源自多细胞动物和原生动物的共同祖先。
在好几个物种谱系(比如蝇、线虫和刺胞动物)中都只有p53样基因而没有p63与p73样基因。另外,在无脊椎动物和脊索动物中,与p63和p73样基因相比,p53样基因似乎具有更广泛的多样性。现有的证据还无法清楚判断p53基因家族的起源,有些证据彼此之间甚至是相互矛盾的。不过,值得注意的是,在现有的已经测序过的包含有p53家族的基因组数据中可以发现,这些基因组中通常都会含有p53样基因,但是通常都会缺乏p63、p73样基因。同样,虽然我们已经在小鼠模型中发现p63和p73基因具有抑制肿瘤的作用,但是在人体肿瘤细胞中通常仍是p53基因发生突变,而不是p63或p73基因。这难道只是巧合,还是说明了什么问题?下面,我们将就这个问题进行讨论,我们主要研究的是p53调控网络中进化保守的部分。
2. 上游调控因子
在哺乳动物中,p53调控网络包括复杂的上游调控因子和下游效应元件。据我们现有的资料显示,p53蛋白在这个调控网络中处于非常重要的中枢位置,它能够整合各种信息,帮助细胞对应激刺激及时做出适应性反应。p53调控网络的上游调控模块主要分为三大类,分别是稳定调控模块(stabilization)、抗阻抑调控模块(anti-repression)和启动子特异性激活模块(promoter-specific activation)。我们还不清楚非哺乳动物中这些调控模块的情况。不过结合一些非哺乳动物的基因组数据以及对黑腹果蝇和秀丽隐杆线虫的研究结果,我们还是得到了一些令人惊奇的实验性结论。比如稳定调控模块和抗阻抑调控模块都使用Mdm蛋白作为主要调控因子(图2)。这个发现也得到了一些其它实验数据的支持,比如在小鼠和鱼类试验中发现,致命性的Mdm2基因缺失和Mdm4基因缺失表型可以通过去除p53蛋白的作用而得到拯救。不过无脊椎动物中缺乏编码MDM2样蛋白的基因以及对黑腹果蝇的研究表明,如果不改变p53蛋白的水平,也能出现因基因损伤而导致的p53基因激活的现象。综上所述,将DNA损伤和p53蛋白激活联系起来的古老调控途径早在MDM2调控途径出现之前就已经有了。因此,无脊椎动物的p53调控网络为我们提供了一个绝好的材料,能够在没有MDM2蛋白的失稳作用的情况下研究p53蛋白是如何被激活的。
那么哪些上游调控机制被保留下来了呢?最有可能的是检查点激酶2(CHK2)。黑腹果蝇的CHK2与哺乳动物的CHK2一样,都能直接磷酸化p53蛋白,这也是细胞遭受电离辐射之后诱发凋亡的必要途径。我们还不知道CHK2蛋白是不是能够直接调控秀丽隐杆线虫体内的p53蛋白同系物CEP-1蛋白,但是CHK2蛋白与ATM、毛细血管扩张性共济失调综合症、Rad3相关蛋白(ATR)以及秀丽隐杆线虫体内的ATR同系物ATL-1蛋白一起,都是细胞遭受紫外线照射损伤之后诱导细胞死亡不可缺少的调控因子。CHK2蛋白在多个物种间都具有的这种相似的调控作用说明,它就是一个高度保守的p53调控因子,同时也说明古老的p53调控途径可能就是通过磷酸化或其它翻译后修饰途径修饰p53蛋白后直接激活p53蛋白的(图2)。

3. 下游效应因子
我们将利用能够区别p53基本功能与衍生功能的无脊椎动物模型的数据做叙述。非哺乳动物的p53蛋白和哺乳动物的p53蛋白一样,都能参与细胞在面对基因毒性应激反应时应该被激活的凋亡途径。正如图2中所示,脊椎动物和无脊椎动物均能招募非常保守的效应因子参与到凋亡调控途径当中,比如BH3-only Bcl-2亚家族和凋亡拮抗剂抑制因子等。另外,在哺乳动物和果蝇中还发现了与DNA修复有关的XRCC5蛋白(又名Ku80蛋白)、核糖核苷酸还原酶蛋白(RNR)以及MutS同系物蛋白(MSH)等效应因子。
相比之下,p21介导的细胞周期停滞途径似乎就不如p53途径这么保守,因为p21途径只限于脊椎动物。比如,斑马鱼中编码p21蛋白的基因可能是p53的靶标,但是在果蝇体内的p21基因却不是p53蛋白的靶基因。
有趣的是,p53蛋白还能调控蠕虫和果蝇细胞的细胞周期,不过蠕虫和果蝇体内的靶标与脊椎动物体内的有所不同。在黑腹果蝇体内丧失能量的细胞中,p53蛋白能够不依赖p21途径而是通过细胞周期蛋白E途径,使细胞周期停滞在G1/S期。同样,CEP-1蛋白能通过靶标PHG-1蛋白(该蛋白是人生长停滞特异性蛋白1 GAS1的同系物)介导紫外线照射诱发的生殖细胞增殖停滞现象发生。我们最近还发现p53蛋白能对自体吞噬作用和代谢作用进行调控,这可能也是p53蛋白非常保守的一项功能。因为我们发现p53蛋白在小鼠体内和蠕虫体内都能对自体吞噬作用进行调控。
p53调控网络的其它作用,比如促使细胞老化等作用可能只限于哺乳动物体内,当然我们也能认为有些作用只限于无脊椎动物体内,但这一观点尚待证实。总而言之,p53调控网络的某些调控作用是非常保守的,比如DNA修复作用和促凋亡作用等可见于各门动物,但其它一些调控作用就没有那么保守,只可见于某一类动物。还有一些有意思的现象,虽然有些p53调控途径是高度保守的,但是参与该途径的效应因子在各个物种间却会有差异,比如RNR蛋白参与的调控途径就是非常典型的例子。在哺乳动物和果蝇体内,RNR蛋白是非常重要的p53效应因子,但是在不同的物种中使用的是不同的亚基。
4. 小插曲——肿瘤抑制作用
那么究竟是什么进化压力迫使p53的功能发生进化的呢?虽然我们目前还无法做出肯定的回答,但我们能够肯定地说阻止肿瘤形成绝不是p53基因原本的功能。主要原因包括以下两点:首先,如图1所示,p53家族成员可见于简单的、寿命很短的生物体和原生动物,这说明远古的p53基因根本不需要承担抑制某些组织细胞生长失控的责任;另外,长期以来,人类的期望寿命都不超过29岁,因此,肿瘤这种发病年龄较晚的疾病也不太可能会对p53基因的进化造成选择压力。而且缺乏p53基因的小鼠和斑马鱼通常都会比野生型的同类寿命更长,并且也没有死于癌症。因此从进化的角度来说,肿瘤并不能对物种繁殖造成任何影响。综上所述,p53基因的抑癌活性很可能源自其它更原始的功能。在脊椎动物中出现得相对较晚的ARF基因同系物(斑马鱼与河豚鱼基因组中都缺乏这些同系物)似乎符合上述推论,因为ARF蛋白能够将p53途径与致瘤应激信号联系起来。
相应地,如果p53家族不具备与肿瘤相关的功能,那么在进化选择过程中,又是为其安排了怎样的功能角色呢?它选择了哪种古老的功能呢?凋亡调控功能是一种可能,因为现有的证据表明,凋亡调控途径的出现要早于p21调控途径(图2)。不过这还是不能解释为什么p53基因会出现在单细胞动物基因组中。p53的其它作用,比如DNA修复和代谢调控等作用也很有可能是在长期进化过程中被保留下来的p53功能。我们只有对其它还不清楚的p53功能和相关的p63及p73的功能有了进一步了解之后才能圆满地解答这个谜题。在这个方面最有前途的是干细胞以及种系组织的发育研究领域以及生理学研究领域。同样神秘也同样相关的问题是哪些种类的应激刺激是原始p53会做出反应的刺激,需要指出的是,大部分用于激活p53途径的实验方法其实都没有深入到“原始”的p53世界当中。因此,现在我们在研究p53家族进化过程中遭受过哪些选择压力时,已经知道的这些刺激信号只能向我们提供部分线索。复制修复信号可能是一种参与p53调控途径形成及选择的适应性压力。不过能够支持这一观点的实验证据目前还没获得,体内自然情况下究竟有多少复制修复信号我们也不清楚。
5. 结论及展望
如果机体选择编码p53样蛋白的基因并不是为了防止肿瘤发生,那么我们想知道,p53的原始功能和保守的p53调控网络真能起到一些与肿瘤相关的作用吗?虽然要回答这个问题还需要一些时日,不过我们推测,答案会来自那些过去被我们忽视的模型,而且我们相信,谜底很快就会水落石出。我们之所以如此乐观是因为首先,我们对p53的认识还存在重大的缺陷,很有可能p53还有一些我们尚未发现的功能。基于这个前提,在肿瘤细胞中出现的与突变型p53基因相关的致瘤表型还没有被完全了解清楚,也不知道有哪些下游效应因子发生了突变;其次,像前面介绍过的那样,DNA损伤能够在不需要MDM2蛋白参与或者稳定p53蛋白的情况下激活p53蛋白。因此,可能存在我们还不知道的能够激活p53蛋白的上游调控途径,这些途径也有可能成为我们抗癌治疗的靶点;第三,p63和p73样基因只见于某些动物体内,但是它们也是动物存活所必需的基因。相比之下,p53样亚家族的分布就广泛得多,不过奇怪的是,p53样基因却不是动物存活所必需的(背景知识1)。这说明p53家族中缺乏SAM基序的那些成员具有某种独特的重要作用。最后一点让我们如此乐观的原因是因为在不会自发形成肿瘤的模式生物中研究与肿瘤相关的分子,比如Wnt蛋白和hedgehog的实际研究工作当中,总是会有一些不可预计的,但很多时候又是非常重要的现象出现。因此我们相信,如果将来使用初级动物或者原生动物来研究p53的功能,可能会得到一些新发现。
背景知识1:p53在发育过程中的作用
动物可以在没有p53基因的情况下生存。缺失了p53基因的小鼠、线虫、果蝇等都能存活,而且都能达到某种程度上的生育水平。不过有趣的是虽然p53基因可见于大部分的真核生物,但是它在发育过程中不是必需的,只能起到一些非必需作用。比如在小鼠胚胎发生期,p53能参与神经管闭合;在青蛙胚胎发生期,p53能参与中胚层分化;在果蝇胚胎发生期,p53能参与细胞程序性死亡。值得一提的是,p53的这种在动物发育过程中的作用也有p63和p73的一份功劳,从理论上来说,p63和p73能补偿p53基因敲除后的功能缺失。另外,在脊椎动物中,p63和p73基因似乎还在发育过程中起到了必需的作用,比如缺失了p63或p73基因的小鼠在胚胎期就会夭折。这看起来似乎是令人困惑、违背直觉的,因为非必需的p53样亚家族在各个物种间的分布要更广。最近的研究表明p53家族成员在种系组织发育和妊娠过程中也发挥了作用。因此,可能是胚胎发育或者种系组织发育过程决定了p53基因的进化历程。
那么我们会从p53的进化历程中得到什么重要结论呢?我们曾认为弄清了p53蛋白的最初功能就能够发现某些隐藏的作用,同时也能利用原始的系统(生物)来发现与肿瘤相关的信息。还有一个尚未解决的问题似乎也与突变型TP53等位基因的致瘤特性有关。
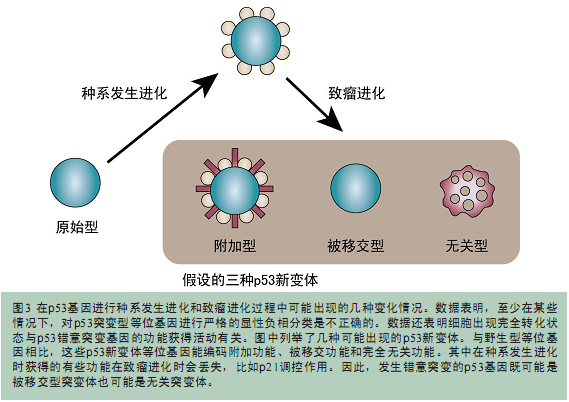
在人体肿瘤细胞中,TP53等位基因可以一个发生错义突变而另一个发生缺失突变。这样就完全排除了显性负相分类的可能,细胞的完全转化状态是由错意突变体造成的。不过,在发现p53蛋白的30年后,发现p53蛋白有意义突变体20年后的今天,我们仍然不清楚大部分p53突变体是如何发挥致瘤作用的。按照经典遗传学的说法,这些等位基因的转化能力可以被看做是一种新变体活性(neomorphic activity)。如图3中所示,这个类别可以被进一步细分。比如有些新变体等位基因属于“附加”变异体(accessorized variants),它们可以增加一些野生型功能之外的功能。有些有些新变体等位基因属于“被移交”变异体(devolved variants),它们只保留了部分野生型功能。还有一些变异体会形成一些新的与野生型功能完全不同的功能,它们被称为无关变异体(unrelated variants)。以目前的资料来看,大部分错义突变的TP53等位基因可能都不属于“附加”变异体,因为这些突变体的高表达并不伴有p53靶基因的高表达。因此,这些突变的TP53等位基因可能属于“被移交”变异体或无关变异体。综上所述,如果致瘤进化形成了“被移交”变异体,那么了解p53的原始功能就能够指引我们回答肿瘤研究工作中的很多基本问题。
原文检索:
Wan-Jin Lu, James F. Amatruda and John M. Abrams. (2009) p53 ancestry: gazing through an evolutionary lens. Nature Reviews CanCer, 9:758-762.
筱玥/编译
三、运用基因工程小鼠研究p53功能20年记
运用细胞和分子生物学方法对p53基因的功能开展研究至今已有30多年了,使用基因工程小鼠对p53基因的功能开展研究至今也已经20多年了。与我们的预期一致,p53基因发生突变的小鼠相比p53基因未发生突变的小鼠,在任何时间段发生各种肿瘤的速度都要快得多。这些基因工程小鼠为我们揭示了很多重要的p53基因的抑癌功能。随着基因工程技术手段的不断发展,研究越来越深入,我们得以对哺乳动物模型体内p53的结构与功能做更精确的研究。
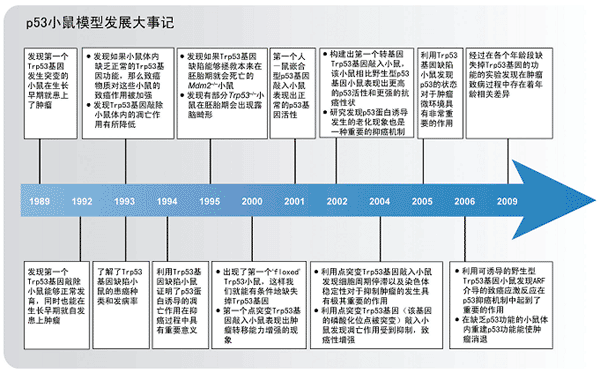
在发现p53基因后的第一个十年,即1979–1989年间,人们主要用改变胞内TP53基因(或小鼠细胞的Trp53基因)或p53蛋白的方法来研究p53的功能。最初,我们认为TP53基因是一种癌基因。不过到了1989年,我们发现p53基因其实是一种抑癌基因,只不过在癌症患者体内它通常都会发生突变。自此,学界掀起了一股研究p53基因的热潮。这段时间出现了一些新型基因工程技术,比如转基因技术和胚胎干细胞技术等。借助这些技术,科学家得以对小鼠的生殖细胞进行遗传改造。1989年,Bernstein等人成功构建出第一个Trp53基因发生突变的小鼠。随后又出现了两种携带有不同Trp53基因突变的小鼠Tg pL53-3和Tg p53-2。它们分别能表达突变p53蛋白A135V和R193P。这些小鼠平均有大约20%的个体在18月龄时会患上肿瘤,即它们的肿瘤发病率相比对照组有明显增加。而且所患的肿瘤类型非常广泛,其中以肺腺癌、骨肉瘤和淋巴瘤最为多见。
鉴于Trp53基因发生突变的小鼠模型能罹患种类如此繁多的肿瘤,我们猜测家族性利弗劳梅尼综合症(Li–Fraumeni syndrome, LFS)可能也与p53基因发生突变有关。1990年,Malkin与Friend等人利用候选基因法发现了LFS的致病基因。他们发现Trp53基因发生突变的小鼠和LFS患者都非常容易患上骨肿瘤、肺癌和淋巴系统肿瘤,所以Malkin等人对LFS患者体内的TP53基因进行了测序。结果发现在大部分LFS患者体内都存在失活的突变TP53基因。此后,大量研究表明,在大部分但不是全部家族性LFS患者体内都存在着胚系TP53基因发生突变的情况。
人工构建的在各种组织里过表达突变Trp53蛋白的转基因动物模型对于我们研究p53的功能给予了极大的帮助。这些动物模型尤其适用于研究各种不同的突变体蛋白在某些特定组织器官内的作用,比如我们经常给突变Trp53基因“装上”各种不同的组织特异性启动子。不过,我们构建的这些转基因动物模型通常采用的都是随机整合的操作方法,这样得到的动物模型的Trp53基因表达水平和蛋白活性都不能够精确地模拟我们在人体肿瘤细胞中观察到的内源基因的真实状况。为了解决这个问题,自1990年起,有科学家试图采用另一种全新的转基因动物模型构建方法,即小鼠胚胎干细胞基因靶向操作技术(ESC gene targeting)构建动物模型。由此而得的动物模型能够更加精确地模拟各种遗传性和后天性肿瘤的TP53基因突变情况。另外,对Trp53等位基因中的一个或两个等位基因的突变失活情况进行研究,能够让我们更加精确地了解p53基因的抑癌作用及其它功能。在此,我们将向读者介绍几种重要的TP53基因改造动物模型,这些模型都曾经在帮助我们发现p53蛋白抑癌作用的研究工作中立下汗马功劳。不过,我们只列举出这些模型并不表示其它模型不重要,我们在表1对其它动物模型做了简要的介绍。


1. 种系Trp53基因突变小鼠模型
1.1 Trp53基因缺失小鼠模型
Trp53基因是利用胚胎干细胞技术进行改造的第一个抑癌基因。1992年,Donehower和Bradley等人就成功构建出了第一个Trp53基因敲除小鼠模型。不久,其它实验室相继报告成功构建出了Trp53基因敲除小鼠模型及其它抑癌基因敲除模型,比如Rb1基因敲除模型和Inha基因敲除模型等。所有这些早期的利用胚胎干细胞技术构建的Trp53基因缺失小鼠模型都缺失了大段的Trp53基因,因此能非常有效地形成无效等位基因,这样每一个动物模型表现出来的发育表型和所患肿瘤都差不多。
第一个出乎我们意料的结果是,我们发现这些缺失了Trp53等位基因的小鼠不论是在胚胎发育期还是在出生后的发育过程中竟然都没有表现出异常。不过,Clarke和Jacks科研团队在1995年对p53缺失的胚胎进行了仔细研究,结果发现有部分雌性胚胎具有致死性的露脑畸形(这种畸形是由于神经管闭合缺陷,结果导致中脑部位的神经组织过度发育所形成的一种畸形)。Clarke等人的这项研究成果表明,至少在某些情况下p53是能够影响动物发育的(背景知识1)。同年,所属的实验室也发现p53蛋白的异常表达能够影响Mdm2基因敲除小鼠的发育。MDM2蛋白是一种E3泛素连接酶,它能够促进p53蛋白经泛素化途径降解。Mdm2–/–小鼠在胚胎发育极早期就会夭折,而这是由于p53蛋白的高活性造成的。Mdm2–/– Trp53–/–小鼠的发育就完全正常,没有问题,这说明MDM2蛋白在胚胎发育过程中所起的作用就是对p53蛋白水平进行调控。不过,p53蛋白在发育过程中不起作用的理论也非常符合它本身作为抑癌蛋白的身份。p53蛋白最主要的功能本来就是对DNA损失和致癌刺激作出反应,而这在胚胎发育期是很难发挥作用的。
背景知识1:TP53基因突变小鼠模型的其它表型:发育表型和生育表型
发育表型 正如正文所述,完全缺失TP53基因功能的小鼠通常都能正常发育,不过有20%~30%的雌性Trp53–/–小鼠胚胎会表现出露脑畸形的情况,这主要是由于胚胎发育过程当中神经管闭合障碍所致。在饲料中添加叶酸能够降低发生露脑畸形的比例。还有研究表明p53能降低胚胎发育过程中的致畸率。比如对发育到第9.5天的Trp53–/–小鼠胚胎施以电离辐射伤害,会造成70%的胚胎出现发育异常以及7%的胚胎死亡;然而对Trp53+/+小鼠胚胎施以同样伤害则只有20%的胚胎会出现发育异常,同时却有60%的胚胎会死亡。p53蛋白在胚胎发育过程中面临DNA损伤时表现出来的这种促凋亡作用能导致胚胎组织损坏和死亡,从而有效避免各种先天性胚胎异常情况的出现。不过如果p53蛋白组成型激活,比如在缺失了Mdm2基因或者Mdm4基因作用的情况下,也会造成胚胎在发育早期出现各种缺陷。
生育表型 我们很早以前就注意到雌性Trp53–/–小鼠的生育能力会降低。最近,Levine实验室发现白血病抑制因子(LIF)是p53蛋白的作用靶标。LIF对于胚胎植入过程非常重要,p53蛋白对于LIF基因的基础转录和诱导转录过程都具有调控作用。雌性Trp53–/–小鼠体内的LIF蛋白含量很低,尤其是在怀孕后第四天即胚胎植入时期情况更为严重。如果给这些孕鼠使用LIF能有效地改善胚胎植入情况。有趣的是,Trp53蛋白第72位脯氨酸密码子的多态性现象(该位点突变与p53促凋亡作用降低有关)与胚胎植入失败密切相关,这也说明p53与生育过程密切相关。
与我们的预计一样,Trp53–/–小鼠很早就会患上肿瘤,它们的平均患病年龄是4.5个月,到了10月龄时所有的Trp53–/–小鼠都会死于癌症(图1a)。而同样的没有Trp53基因缺陷的小鼠的寿命一般都在24个月至36个月之间。和转基因Trp53小鼠一样,p53无效小鼠所患的肿瘤类型也是多种多样的,比如有T细胞淋巴瘤和各种不同组织来源的肉瘤等(图1b)。相比野生型小鼠,Trp53+/–小鼠也表现出了肿瘤扩散更快的现象,不过Trp53+/–小鼠的肿瘤患病年龄还是没有Trp53-/–小鼠早。杂合型p53基因携带小鼠的平均患癌年龄在18个月。另外,Trp53+/–小鼠所患的肿瘤类型也与Trp53-/–小鼠有非常明显的差异。比如Trp53+/–小鼠常患的肿瘤包括原发性B细胞淋巴瘤、骨肉瘤、软组织肉瘤以及各种癌症(图1)。我们目前还不清楚是什么原因导致了这种疾病谱方面的差异。由于Trp53+/–小鼠和人LFS患者都非常容易患上软组织肉瘤、骨肉瘤和淋巴瘤,因此Trp53+/–小鼠非常适合用做LFS疾病的病理模型(背景知识2)。

背景知识2:Trp53基因缺陷小鼠模型真能成功模拟利弗劳梅尼综合症(LFS)吗?
从遗传学角度来讲,LFS患者与TP53+/–人群非常类似,但是这就意味着Trp53基因缺陷小鼠模型真能成功模拟LFS吗?携带Trp53无效等位基因的TP53+/–小鼠大约能够模拟LFS患者体内20%的基因突变情况,比如框移突变、缺失突变、剪接位点突变等各种会造成无效等位基因的突变。其它的LFS突变主要都是DNA结合结构域相关的热点突变。LFS患者体内有两种热点突变,即R175H和R273H已经成功构建并植入小鼠模型中。
大约有50%的Trp53基因突变小鼠在18月龄时会患上肿瘤,这种发病情况与Trp53基因发生点突变和缺失突变时的情况相类似。LFS患者到30岁时有一半人会患上癌症。按照预期寿命计算(即小鼠的预期寿命是3岁,人的预期寿命是80岁),Trp53基因缺陷小鼠模型与LFS患者的发病情况是一样的。不过,Trp53基因缺陷小鼠模型所患肿瘤的疾病谱与LFS患者的疾病谱只有部分重合。Trp53基因缺陷小鼠模型最常患的肿瘤是骨肉瘤、软组织肉瘤和淋巴瘤,这些也都是LFS患者常见的肿瘤。不过各种癌症,尤其是乳腺癌却只常见于LFS患者而在Trp53基因缺陷小鼠模型中并不常见。Jacks和Lozano实验室构建了Trp53 R172H和Trp53R270H这两个对应于LFS患者体内非常常见的R175和R273热点突变的动物模型。这两个动物模型的癌症发病率要比Trp53+/–小鼠模型高得多,但是它们的乳腺癌发病率仍然不高。不过有趣的是,如果使用乳腺癌易感的Balb/c小鼠而不是不易患乳腺癌的C57BL/6小鼠来构建Trp53+/–小鼠模型,那么就会有55%的模型患上乳腺癌,而且这种模型的患病谱会更加接近LFS患者的患病谱。Varley注意到遗传了致癌点突变的LFS患者家族相比遗传了失活点突变的LFS家族要更容易(更快)患上更多种类的肿瘤。携带一个致癌热点突变基因(R172H或R270H)的杂合型小鼠与Trp53+/–小鼠的发病率是一样的,但是杂合型小鼠体内的肿瘤更容易发生转移。综上所述,各种杂合型Trp53基因突变小鼠模型都能从某一个或某一些方面模拟LFS疾病,但是不能从各个方面来模拟LFS疾病。
p53基因作为一个典型的抑癌基因应该遵从Knudson提出的“二次打击”学说,即这些抑癌基因都属于阴性基因,只有当两个等位基因都失去活性才会导致肿瘤形成。根据对Trp53+/–小鼠肿瘤组织中野生型Trp53等位基因的分析,我们得以对上述“二次打击”学说进行检验。在上述被检肿瘤组织中有大约一半组织的野生型Trp53等位基因出现缺失,这也支持了“二次打击”学说。但是与此同时,仍然有近一半的野生型Trp53等位基因具有功能。这种仍然有半数肿瘤细胞保留了野生型p53基因的现象同时也支持了另一种“单一不足(haploinsufficient)理论”的观点。该理论认为只有一半的等位基因是不足以发挥p53的抑癌功用的,如果TP53基因的表达量降低一半,那么p53蛋白的表达和活性就能够促使肿瘤发生。不过,在Balb/c小鼠模型中有超过90%的肿瘤都表现出了Trp53等位基因杂合型缺失的现象,这表明单一不足理论也会受到动物遗传背景的影响。有趣的是,大部分LFS患者所患的肿瘤组织中都携带有失活的TP53等位基因,因此无法表达p53蛋白,这些患者同时也丢失了“幸存”的野生型TP53等位基因,这种现象也符合二次打击学说。
Trp53基因敲除小鼠被广泛用于各种肿瘤和非肿瘤研究领域。将各种易患肿瘤的小鼠进行杂交通常都能得到对肿瘤高度易感的后代,在某些情况下还会改变其生物属性。Trp53–/–小鼠最近被用来研究肿瘤微环境对肿瘤扩散具有何种作用,这方面的研究发现与肿瘤相关的间质中p53的状态也具有非常重要的作用。前列腺上皮组织中Rb通路的失活会导致组织大范围发育异常,结果形成微小浸润性癌(minimally invasive carcinomas)。在上皮肿瘤组织和间质组织中转染SV40大T抗原截短体能够使Rb通路失活,然后诱导p53蛋白表达。Trp53杂合体能加快患上腺癌的速度,也能促进腺癌转变成恶性肿瘤。还有一个重大发现,那就是将正常的间质组织与肿瘤组织一起培养后能抑制肿瘤扩散。虽然肿瘤上皮细胞仍然会有p53蛋白表达,但如果缺失了一个Trp53等位基因,那么间质成纤维细胞的生长和肿瘤细胞的增殖都会加快。这些结果表明非细胞自主机制在抑癌过程中也发挥了重要的作用,而p53蛋白也参与了这个过程。
自从Trp53–/–小鼠模型被成功构建后,它们就一直被广泛用于研究p53蛋白在各种肿瘤和非肿瘤组织中的作用(背景知识1、3)。此外,研究人员还利用Trp53–/–小鼠模型与其它有相关抑癌基因或致癌基因突变的动物模型杂交的方法研究了p53信号通路与其它抑癌和致癌信号通路之间的相互关系。完全缺失p53基因功能的细胞的建立又带给我们极大的帮助,从而发现了多条p53信号通路以及p53调控因子、与p53发生相互作用的因子以及p53的靶因子等等。这类研究最早开展于1993年,当时在放射线诱导凋亡试验中发现的Trp53–/–淋巴细胞相比p53基因野生型淋巴细胞发生凋亡的现象明显减少,这进一步证明了p53在DNA损伤和凋亡反应当中具有重要作用。这也表明Trp53–/–小鼠模型及其相关细胞在有关p53的各种细胞过程和信号通路的研究中非常实用,而且它们也一直被广泛应用于各个相关领域。
背景知识3:Trp53基因突变小鼠模型的其它表型:老化和组织稳态
老化 本文中介绍过的大部分的Trp53基因突变小鼠模型体内p53蛋白的活性都有缺失或者降低。不过也有几个模型的情况恰好相反,这些模型都是通过基因敲入技术或转基因技术构建而成,因此它们体内p53蛋白的活性反而有所升高,模型相比野生型小鼠对肿瘤具有更强的“抵抗力”。不过有趣的是,这些抗癌小鼠的寿命通常也都与野生小鼠不太一样,有的模型小鼠的寿命会延长,而另一些模型小鼠的寿命却会缩短。有两种超等位基因的p53模型能表达部分的p53蛋白,即缺失了氨基端部分序列的p53蛋白,这些模型小鼠就表现为寿命缩短和衰老速度加快。Serrano实验室构建的另外3种超等位基因的p53模型。该模型含有额外的完整Trp53基因拷贝。这种p53模型包括超Trp53基因模型,超ARF-Trp53模型(即通过ARF来激活p53蛋白),还有通过ARF、INK4A以及端粒酶共同激活p53蛋白的模型。其中只有超Trp53基因模型表现出了抗癌表型,其它另外两个模型小鼠的寿命都有所延长,衰老的速度也有所减缓。同样,Mdm2基因次形态突变(Hypomorphic mutations,该突变会使基因的活性减弱但不会消失)也能提高p53蛋白的活性,增强细胞的抗癌性,但是不会影响到小鼠的寿命。Trp53基因截短突变体和超等位基因Trp53小鼠表现出来的相反表型被认为是p53调控机制方面的差异所造成的。在Trp53基因截短突变体模型中,p53蛋白是被慢慢上调的,但是在超等位基因Trp53模型中p53蛋白面对各种应激刺激的反应会迅速增强。
干细胞和组织稳态 许多研究发现p53蛋白还能够调控干细胞的功能。研究发现,Trp53基因缺失模型小鼠的干细胞增殖能力明显增强,自我更新能力及其它功能与普通小鼠干细胞差别不大。根据对这种小鼠模型来源的造血干细胞的研究发现,p53蛋白能调控维持造血干细胞沉默状态的细胞因子。最近对Trp53基因缺失模型小鼠的研究还发现,如果还同时缺失了ARF和INK4A,那么血液系统的补充速度会减缓10倍。另一项研究表明,如果同时缺失了Trp53基因和抑癌基因PTEN,那么会增强神经干细胞的增殖能力和自我更新能力。Trp53–/– Pten–/–神经干细胞很难发生分化,同时细胞MYC的表达量会上调,这也解释了为什么这些细胞容易形成神经胶质瘤。正常干细胞形成肿瘤干细胞的过程可能就是部分因为Trp53基因和其它抑癌基因发生突变所致。Trp53基因缺失小鼠模型的出现进一步方便了这方面研究的开展。
1.2 Trp53癌基因错意突变小鼠模型
很明显,p53基因缺失小鼠将在p53信号通路体内研究当中继续发挥重要作用。不过大约有80%的人体体细胞肿瘤组织或LFS患者肿瘤组织中发生的TP53基因突变是错意突变。大量的组织培养实验表明,p53突变蛋白为肿瘤细胞提供了额外的生长优势。很有可能是p53突变蛋白与其它细胞因子间的相互作用,以及p53突变蛋白所发挥的转录活性赋予了肿瘤细胞这种生长优势。这些体外实验结果促使我们构建了突变型TP53癌基因敲入小鼠模型,希望用这种模型来研究错义突变TP53基因在体内的功能,以及比较错意突变TP53基因和缺失TP53基因会给小鼠造成什么影响。
我们已经在人体肿瘤组织中发现了数以万计的TP53错意突变基因,登录IARC TP53错意突变数据库(http://www-p53.iarc.fr/)可以了解更多相关信息。TP53基因中的突变热点毫无疑问地成为了大家在动物模型中的研究热点。p53-R172H突变(相当于人体p53蛋白中第175位氨基酸位点突变)能破坏p53蛋白的DNA结合结构域,该突变也是目前为止在细胞培养中发现的最具“侵袭性”的突变。p53-R270H(相当于人体p53蛋白中第273位氨基酸位点突变)具有野生型p53蛋白的构象,但是由于该位点是p53蛋白直接与DNA相接触的位点,因此该突变体不能与DNA相结合。这两种突变体在各种组织培养试验中都表现出了明显的功能获得表型。比如,在缺乏TP53基因的细胞内表达人源性p53-R175H蛋白和p53-R273H蛋白会增强细胞在软琼脂上的生长活力,也能增强这些细胞在裸鼠体内的致瘤性。我们也在小鼠生殖细胞系里构建了上述突变基因的敲入模型,其中第一个模型是由Lozano实验室于2000年构建成功的p53-R172H基因敲入模型。
出人意料的是,R172H–R270H杂合型基因敲入小鼠模型在生存特征方面与Trp53+/–小鼠相比并没有表现出明显的统计学差异。另外,我们还发现纯合型Trp53基因突变小鼠与Trp53+/–小鼠相比在生存情况方面也没有表现出明显差异。不过,与Trp53+/–小鼠相比,杂合型Trp53基因突变小鼠体内的肿瘤则具有很强的转移能力(图2)。在Trp53R172H/+小鼠体内,大约有23%的骨肉瘤和67%的腺癌会发生转移。在Trp53 R270H/R270H小鼠体内,29%的肺腺癌会表现出转移征象。这种肿瘤转移能力在129/Sv×C57BL/6杂交体里会增强,而在上述杂交体与C57BL/6小鼠的回交体里这些肿瘤的转移能力又会降低。我们目前还不清楚上述这些遗传背景的差异对肿瘤转移能力的影响,但是可以肯定遗传背景对肿瘤的转移能力的确是存在影响的。

这些p53突变基因小鼠模型的发展也加深了我们对p53突变蛋白体内稳定性调控机制的了解。由于这些突变蛋白在体内非常稳定,因此我们可以利用免疫组化技术在人体肿瘤组织中经常发现这些突变蛋白。这一点与野生型p53蛋白的情况恰好相反。在正常细胞里野生型p53蛋白的含量都非常低。不过在纯合型或杂合型Trp53突变小鼠体内的肿瘤组织中,不论Trp53基因发生了何种突变,这些p53突变蛋白也并不稳定(虽然我们还无法判断肿瘤组织中的野生p53蛋白和突变p53蛋白的稳定性差异)。根据对Trp53R172H/R172H小鼠和Trp53R270H/R270H小鼠体内正常组织的研究,我们发现突变p53蛋白缺乏稳定性。这说明将野生型p53蛋白维持在低水平的机制同样也能对p53突变蛋白发挥调控作用。这些数据表明还存在其它的肿瘤特异性事件来稳定p53蛋白。
各种信号通路,比如DNA损伤通路、癌基因激活通路、化疗药物作用通路以及核糖体应激通路等都能起到稳定野生型p53蛋白的作用。我们已经知道上述信号通路中有些能起到稳定突变p53蛋白的作用,我们估计上述通路中其它的通路也能起到相同的作用(图2)。细胞内缺乏Mdm2蛋白会导致p53依赖性细胞死亡事件的发生,这也支持了上述观点。Trp53–/– Mdm2–/–双重基因敲除小鼠模型的存活率非常高,也表现出与缺乏Trp53基因的小鼠模型相同的肿瘤表型。Trp53R172H/R172H突变模型表达的是缺乏功能的Trp53等位基因,它也能拯救Mdm2–/–表型。在各种正常组织中如果缺失了Mdm2基因也能够稳定p53-R172H蛋白。
那么这些突变的p53蛋白稳定之后会给体内带来什么样的后果呢?Trp53R172H/R172H Mdm2–/–小鼠相比Trp53–/– Mdm2–/–小鼠罹患肿瘤的时间更早,而且肿瘤的转移能力更强。缺乏Mdm2基因的Trp53R172H/R172H小鼠平均存活期只有130天,而Trp53R172H/R172H小鼠以及Trp53–/– Mdm2–/–小鼠的平均存活期有170天。不过,Mdm2基因缺失并不是一个肿瘤特异性的事件,这是一个非常简单而又有用的模型,可以帮助我们了解突变p53蛋白在体内的稳定情况以及该突变蛋白赋予细胞的新表型。另一个肿瘤特异性的事件是缺失了细胞周期抑制蛋白——INK4A蛋白(该蛋白由Cdkn2a基因座编码)。缺失该蛋白能够上调体内的p53通路活性。Cdkn2aINK4A缺失会导致细胞周期蛋白D——细胞周期蛋白依赖的激酶复合体(cyclin D–cyclin-dependent kinase complexes)释放,然后该复合体能够磷酸化RB蛋白。RB蛋白磷酸化之后又会释放转录因子E2F1,继而激活ARF。ARF会抑制MDM2活性从而稳定并激活p53蛋白。这样我们就可以利用突变的Trp53蛋白来选择肿瘤细胞。为了验证INK4A蛋白对突变p53蛋白起到的稳定作用是否具有重要意义,我们构建了Trp53R172H/R172H Cdkn2aINK4A–/–小鼠模型。这些小鼠模型体内的很多细胞(但不是所有细胞)都表现出能够稳定胞内突变的p53蛋白的现象,而且与Cdkn2aINK4A–/–小鼠模型相比,这些模型的存活时间都有所缩短,肿瘤转移现象也都有所增加。因此,我们在缺失了Trp53基因和有一个Trp53等位基因发生突变的小鼠模型上观察到的相似的无瘤存活时间的情况,可能是因为需要额外的基因组损伤来稳定突变p53蛋白这是一个限速步骤。
因为细胞的培养条件中充满了各种应激因素,所以我们在两个Trp53等位基因都发生突变的小鼠模型的胚胎成纤维细胞中也观察到了突变p53蛋白的稳定现象以及该蛋白给细胞带来的新表型。相比Trp53–/–细胞,携带了一个或两个突变Trp53等位基因的小鼠胚胎成纤维细胞的增殖能力都有所增强,转化能力也有所提高。由于突变p53蛋白能够与p53家族成员p63和p73相结合并抑制它们的活性,因此我们也经常在这些新增表型实验当中研究p63和p73的作用(背景知识4)。实际上,突变p53蛋白表达下调能增强p63和p73的转录活性,反之,p63和p73表达下调能增强Trp53缺失细胞(但不是Trp53突变细胞)的转化活性。另外,缺失了一个Trp63或Trp73等位基因的Trp53+/–小鼠体内所患肿瘤的转移能力要比Trp53+/–小鼠肿瘤的转移能力强。这些试验证据都表明,体内如果缺失了p53家族蛋白会对肿瘤的转移能力造成很大的影响。体内突变p53蛋白的不稳定现象可能削弱了它对p63和p73的抑制作用,因此Trp53突变小鼠出生之后能够正常发育。另外,如果突变p53蛋白能够稳定存在(比如在缺失了Mdm2或Cdkn2aINK4A的情况下),但也不可能在所有种类细胞中都稳定存在,这样就只能部分影响p63和p73的活性,而这同样能够避免由于缺失了Trp63和Trp73会出现的胚胎发育夭折表型出现。
于是问题来了,在肿瘤形成过程中是否有足够的突变p53蛋白来抑制p63和p73蛋白的功能呢?究竟需要抑制掉多少p63和p73蛋白的功能呢?通过对Trp63+/– Trp73+/–小鼠模型的研究发现,只要将p63或p73蛋白中的任何一个蛋白抑制掉一半就足以表现出转移瘤的表型。可能只要随机影响一两个细胞中的p63或p73蛋白功能就足以促使转移瘤的发生。因此,上述这些体内试验结果证实了如果突变p53蛋白抑制了p63或p73蛋白的功能,那么就能造成肿瘤转移性增强的表型。不过我们也不能排除还有其它机制参与其中共同发挥作用,因为突变p53蛋白还能够与其它很多蛋白相结合。
总而言之,这些体内试验结果让我们了解到p53蛋白稳定性调控机制也具有非常重要的意义;了解到稳定野生型p53蛋白的机制同样也能够稳定突变p53蛋白;了解到突变p53蛋白一旦被稳定就能长时间稳定存在;还能了解到突变p53蛋白的稳定对于细胞获得新功能以及带来显性负相活性都是必须的(图2)。这些模型在帮助我们了解哪些细胞种类特异性事件以及肿瘤特异性事件能够稳定p53蛋白的研究工作中具有非常重要的价值,同时也能帮助我们了解肿瘤转移的分子机制。
背景知识4:p63和p73突变小鼠模型
p53家族共有三个成员,分别是p53、p63和p73,其中p63和p73具有很高的序列相似性和结构域保守性。虽然毫无疑问,p53蛋白是一个抑癌因子,但是p63和p73是否也是抑癌因子还存有争议。争议的部分的起因是因为Trp63基因和Trp73基因都能形成多种RNA同工型。这些同工型之间的区别就在于是否含有N末端的反式激活结构域,其中含有这些结构域的被称为TAp63和TAp73,不含的被称为∆p63和∆p73。现有的证据表明∆p63和∆p73具有致癌活性,而TAp63和TAp73具有抑癌活性。缺失了Trp63基因的小鼠模型发育会出现异常,四肢和皮肤不能发育。Trp63+/–小鼠的寿命会缩短,老化会加速,不过不容易罹患癌症。但是另一项研究发现Trp63+/– Trp53+/–小鼠的患癌率明显高于Trp53+/–小鼠,这说明在p53表达降低的情况下p63能起到抑癌的作用。弄清楚各个组织中各种p63同工型的作用将有助于我们判断p63的“真实身份”。
早期对完全缺失了Trp73基因的小鼠模型的研究未能证明该基因的抑癌功能。该小鼠模型表现出明显的发育缺陷,但是能存活到出生以后,而且在15月龄之前都不会患上各种肿瘤。但是研究发现Trp73+/– Trp63+/– Trp53+/–小鼠的肿瘤发病率有明显增高。为了弄清楚p73的作用,Mak等人进行了深入研究,他们发现表达∆p73蛋白同时缺乏TAp73蛋白的小鼠的致癌率相比野生型小鼠有一定程度的增加,这说明TAp73蛋白具有一定程度的抑癌作用。
1.3 缺失了部分功能的Trp53突变小鼠模型
科研人员还利用小鼠模型对各种p53突变体进行了更加精细的研究。比如R172P突变体就是一个功能分离突变蛋白。该蛋白能使细胞周期阻滞,能部分激活p21蛋白,但是不能有效诱导凋亡发生。不过令人吃惊的是,Trp53R172P/R172P小鼠却发育正常,而且相比Trp53–/–小鼠,Trp53R172P/R172P小鼠发生肿瘤的速度更慢,这说明p53蛋白阻滞细胞周期的作用在p53蛋白的抑癌活性中也是非常重要的一个组成部分。这些在Trp53R172P/R172P小鼠体内形成的肿瘤还有一个重要特征,那就是它们还都具有倍性(ploidy),这说明维持基因组的稳定性也是一条重要的抑癌机制。由于p21蛋白在p53介导的细胞周期调控途径和细胞老化途径中具有绝对的“领导作用”,因此有人将Trp53R172P/R172P小鼠与缺失了p21编码基因的Cdkn1a缺失小鼠杂交,来研究p21蛋白对于维持染色体稳定以及推迟肿瘤发病是不是必须的。我们在Trp53R172P/R172P Cdkn1a–/–小鼠模型中发现,缺失了Cdkn1a基因能够让p53-R172P细胞完全丧失细胞周期阻滞功能,并且会加快肿瘤形成。
对Trp53R172P/R172P Cdkn1a–/–肉瘤和Trp53R172P/R172P Cdkn1a–/–淋巴瘤进行细胞遗传学检测发现,它们都具有非整倍性(aneuploidy)和染色体畸变现象,这种情况在Trp53R172P/R172P肿瘤中是观察不到的。因此,体内p21蛋白在细胞周期阻滞和维持染色体稳定性方面的作用与p53蛋白的促凋亡作用是相辅相成的,它们共同起到抑制肿瘤形成的作用。上述研究结果表明,p53蛋白促使细胞周期停滞与诱导细胞老化或凋亡这几项功能共同发挥作用,相互协作,使得p53蛋白能够抑制肿瘤发生和扩散。
p53蛋白其它氨基酸位点,比如各种翻译后的磷酸化修饰位点、泛素化修饰位点以及苏素化修饰位点等发生突变的小鼠模型也已构建成功。重要的是,虽然这些突变都破坏了p53蛋白的翻译后修饰途径,但是并没有对p53蛋白的功能造成什么影响。这些小鼠模型通常都只会表现出轻微的肿瘤抑制功能缺陷,这说明还存在一些上游信号通路来发挥修饰并激活p53蛋白的功能。有一个极佳的例子非常能够说明这种翻译后修饰状态的改变会对p53蛋白抑癌功能能造成轻微的影响。Trp53S18A/S18A突变小鼠体内p53蛋白的关键丝氨酸磷酸化位点被突变成了丙氨酸。该磷酸化位点能够在DNA发生损伤时被ATM激酶所磷酸化。这种突变小鼠细胞在面对DNA损伤时所能发挥的诱导细胞凋亡的功能的确会有所减弱,但在DNA损伤检查点的激活和细胞增殖方面的作用都没有受到任何影响。不过1至2岁的小鼠会表现出致瘤率略微增加的情况,这说明哪怕p53蛋白只是发生了一点点突变,比如第18位的丝氨酸突变为丙氨酸,也会给p53蛋白的抑癌功能带来影响。p53-S23A突变小鼠也会表现出患癌率略微升高的现象,这种两个等位基因都发生S23A突变的小鼠与Trp53+/−小鼠在致瘤表型方面非常相似。同时将S18和S23位点都突变掉并没有带来累加效应,这种双位点突变小鼠的致瘤表型与单位点的纯合型p53-S23A突变小鼠是一样的。实际观察到的在p53蛋白翻译后修饰位点中缺乏与致瘤表型相关的突变这一现象也非常符合上述实验结果,不过我们还需要对这些位点进行更深入的研究。
2. p53条件突变小鼠模型
2.1 p53条件突变小鼠模型
前面介绍的这些p53小鼠模型都是Trp53基因发生了种系突变的动物模型。这种动物体内每一个细胞和组织都会表达同样的突变体等位基因。不过随着基因靶向技术越来越富有“弹性”,即可操纵性,科研人员们又构建出了p53条件突变小鼠模型。我们可以对这种模型动物体内的Trp53基因进行时、空调控。我们可以对某个特定组织里的p53基因进行缺失或突变,可以使小鼠的p53基因只在发育阶段、青春期或者成年后发生突变,也可以使其一生都发生突变。同样,野生型p53基因也能够用同样的方法进行调控,可以使它们在某些特定组织里激活,也可以被广泛激活。我们将在下文中对这类方法进行介绍。随着这方面技术和模型构建工作的进展,我们对p53蛋白的抑癌作用又有了更深一步的了解。
早在2000年,Berns实验室就报道了第一例野生型Trp53等位基因条件控制小鼠模型Trp53flox/flox。Berns等人将LoxP重组位点构建到了Trp53基因的第2个内含子和第10个内含子当中,这样就能利用Cre重组酶对这种‘floxed’ Trp53基因进行重组操作或者缺失操作,从而在特定组织中抑制p53蛋白的表达。有时还会一起抑制掉‘floxed’ Rb1基因,由此获得许多组织肿瘤动物模型。多种肿瘤动物模型,例如成神经管细胞瘤(medulloblastoma)、骨肉瘤(osteosarcoma)、皮肤鳞状细胞癌(skin squamous cell carcinoma)以及乳腺癌模型等都是利用这种方法构建成功的,因为这种方法能快速构建出我们所需要的肿瘤模型。
虽然floxed p53基因小鼠模型最初是用来研究在特定组织中缺失了p53蛋白会给动物造成何种影响的,但是Donehower等人还利用这种模型用更整体的方法研究了后天缺失Trp53基因之后会造成什么后果。Donehower等人将floxed p53基因小鼠与另一种小鼠(这种小鼠模型体内的广泛表达Rosa26的基因座中被敲入了雌激素受体基因CreERT2,该受体基因对他莫昔芬非常敏感,同时还融合了Cre)进行杂交,这样得到的子代小鼠如果注射他莫昔芬,那么小鼠体内大部分组织中的Trp53基因都会发生缺失。在小鼠3月龄、6月龄和12月龄时分别注射他莫昔芬就会发现Trp53基因缺失之后所形成肿瘤的潜伏期具有年龄相关差异。如果在小鼠12月龄时缺失掉Trp53基因,那么发生肿瘤的速度要比在小鼠3月龄时缺失掉Trp53基因时快得多,这种情况也非常符合另一种模型的理论。该模型认为组织会随着年龄的增长不断积累发生了癌变的细胞,只不过这些细胞都被野生型的p53蛋白的检查点功能阻滞了而已。
在众多后天失活野生型p53蛋白的方法当中还有一种方法是由Jacks实验室构建的。Jacks等人构建了一种双Cre激活的突变p53小鼠模型。该模型含有一个Lox-SToP-Lox(LSL)盒结构。LSL盒被放置于敲入基因Trp53R172H或Trp53R270H的上游,在单倍体精子细胞中表达Cre酶就能形成种系p53突变后代。另一种方法就是将该模型与某些组织特异性Cre小鼠模型杂交,这样就能得到仅在该组织中发生p53突变被激活的子代小鼠。比如乳腺组织特异性的Wap-Cre小鼠与LSL-Trp53R270H小鼠杂交产生的后代就能很快患上乳腺癌。不过,需要在此提醒的是,这类小鼠模型有一个特点,那就是在Cre介导切除LSL盒之前这些突变的等位基因是不能表达p53蛋白的,因此在不表达Cre酶的组织里可能会形成肿瘤。我们在分析这些小鼠模型的实验数据时要注意上述特点。
2.2 p53条件型野生小鼠模型
正如前文所述,用来条件失活野生型p53基因或者条件激活突变型p53基因的方法具有相当的可操控性。因此也有人利用相应的方法来构建条件激活的野生型p53基因模型,利用这些模型可以很方便地检验在肿瘤细胞里重建p53活性是否能够推迟甚至逆转肿瘤的发生。如果真是这样,那么我们对p53的抑癌活性又会有新的了解。另外,这种方法也具有非常重要的临床实用价值。Evan实验室曾经进行过这方面的研究。他们构建了一个野生型p53基因敲入模型——Trp53ER(TAM)。该敲入p53基因上融合了一个雌激素受体片段,它能够被雌激素类似物4羟基他莫昔芬(4-OHT)所激活。在纯合型Trp53ER(TAM)小鼠体内,不论有无应激信号刺激,p53基因都处于失活状态,不过4-OHT能够激活该p53基因。Evan等人借助该模型发现电离辐射诱导实验小鼠患上淋巴瘤的时间在使用了6天4-OHT的实验组要比对照组推后了8天。有趣的是,如果在辐射照射时激活p53蛋白那么就可以观察到明显的由p53蛋白诱导的凋亡现象发生,但是不能推迟淋巴瘤的产生。该结果表明p53介导的DNA损伤应答反应与其抑癌作用无关。另外,还发现这种依赖p53激活的淋巴瘤抵抗现象是完全依赖ARF蛋白的,该蛋白也由Cdkn2a基因座编码,是p53蛋白的活化因子,能够对致瘤应激刺激作出反应。
因此,至少在这种情况下p53蛋白所发挥的主要抑癌作用并不是立即清除掉发生了DNA损伤的细胞,而是通过ARF介导的途径来抑制少数癌基因被激活的细胞克隆的增殖。不过在分析这些实验数据时有一点要特别注意,那是因为Trp53ER等位基因并不是无效等位基因,Trp53ER纯合体不能拯救Mdm2-表型。因此这种推迟肿瘤形成的表型可能是因为残存的p53活性足以杀灭异常细胞所致。
Evan、Jacks以及Lowe实验室还使用这类条件激活的野生型p53动物模型发现了恢复p53功能能够使肿瘤明显消退的现象。不过,他们每一个实验室使用的动物模型和激活p53的方法都各不相同。每一个实验室都发现由于缺乏p53活性而出现的肿瘤细胞里还都包含有完整的p53信号通路,当有野生型p53蛋白存在时这些通路又都可以马上被激活。Evan实验室使用的是Trp53ER(TAM)模型来激活Eμ-Myc淋巴瘤模型体内的p53蛋白;Jacks实验室使用的是LSL-Cre方法来抑制自然发生的淋巴瘤和肉瘤;Lowe实验室使用的是可被多西霉素抑制的shRNA技术来激活肝癌小鼠模型体内的野生型p53蛋白。有趣的是,虽然每一个模型在激活了野生型p53蛋白之后都表现出了非常明显的抑癌作用,但是p53蛋白的抑癌机制还是因“癌”而异的。在淋巴瘤中起主要作用的是细胞凋亡作用,而在肝癌和肉瘤中起主要作用的则是促进细胞老化机制。在肝癌模型中,p53诱导的细胞老化过程能产生炎性因子,激活先天免疫反应,以此来清除肿瘤细胞。因此很明显,这些体内试验证据都表明p53依赖的凋亡反应、细胞周期停滞反应和肿瘤细胞老化反应都是细胞类型特异性的抑癌反应。这些激动人心的研究成果让我们相信,在肿瘤细胞里重建p53的功能也许可以起到意想不到的治疗作用。不过,Evan等人的动物模型在激活了p53之后肿瘤出现了复发现象,这可能是由于细胞缺乏ARF或者是可诱导的Trp53基因本身的原因。另外,还需要注意的是,大部分人体肿瘤都含有突变p53基因,我们还不清楚在这些细胞内重建野生型p53蛋白功能是否能够起到明显的抑癌作用,因为同时还存在着大量稳定的突变p53蛋白。
3. 结论及展望
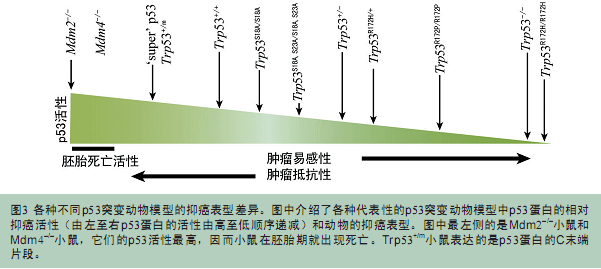
能够在完整的哺乳动物模型体内操控并研究Trp53基因,这种技术上的进步极大地加深了我们对p53蛋白各种功能(包括与肿瘤相关的功能和不与肿瘤相关的功能)的了解。尤其是观察到将各种类型的突变Trp53基因敲入小鼠基因组之后能够决定“继发”的肿瘤类型。我们在图3中详细介绍了各种肿瘤易感性。图中还展示了各种Trp53基因代表突变模型里p53蛋白的活性曲线。p53蛋白的突变本质决定了最终形成的肿瘤类型。需要注意的是,热点突变模型Trp53R172H/R172H小鼠相比Trp53–/–小鼠更容易罹患肿瘤,这不是因为它们形成肿瘤更早,而是因为Trp53R172H/R172H小鼠体内的肿瘤经常发生转移。这种差异说明各种p53突变体可能会赋予细胞新功能,而不仅仅只是丧失p53的功能。另外,诸如R172P和S18A等多种p53突变体都还部分保留了野生型p53蛋白的功能,因此携带这些突变基因的小鼠模型相比Trp53–/–小鼠来说,致瘤率会相应地有所降低。最后,各种Trp53基因超等位基因突变体小鼠,例如超Trp53基因小鼠和Trp53+/m小鼠等都有明显的抗癌表型,而且寿命也会有所变化(超Trp53基因小鼠的寿命没有变化)。因此可以得出结论,超过正常水平的p53蛋白活性能够增强抗癌效果,而这种超常的p53活性对于小鼠寿命的影响则视p53的调控情况而各有差异(背景知识3)。尽管小鼠能够耐受高水平的野生型p53蛋白活性,但这种耐受并不是毫无止境的,而是存在一个上限的,比如Mdm2–/–小鼠和Mdm4–/–小鼠都具有非常高水平的野生型p53活性,因此它们在胚胎发育早期就会夭折。
图3中所示的各种p53小鼠模型都是种系模型。这些模型正逐渐被各种新出现的可对p53表达及活性进行后天时、空调控的p53模型所替代。随着这些新模型以及将来可能出现的更加先进的技术的问世,我们将能够了解更多、更重要的信息,这将帮助我们解答更多有关p53抑癌机制的问题。比如p53诱导的细胞凋亡、细胞周期停滞、细胞老化等机制对于特定组织中的抑癌效果究竟是重要还是不那么重要呢?有没有其它的重要机制参与p53介导的抑癌作用?在各种情况下,p53介导的DNA损伤反应是否总是没有p53介导的致瘤应激反应重要吗?这些抗癌p53应答反应是暂时发挥作用还是持续发挥作用?p53蛋白对细胞的新增功能和显性负相作用的本质是什么?各种不同热点突变是否真的能导致机体形成不同的肿瘤?p53蛋白究竟是主要起到“看门人”的作用(阻止肿瘤发生)还是主要起到“管理者”的作用(防止基因组失稳)?在将来会有越来越多的动物模型出现,我们也会渐渐揭开上述谜题的答案,还将发现更多出乎我们意料的新信息。
原文检索:
Lawrence A. Donehower and Guillermina Lozano. (2009) 20 years studying p53 functions in genetically engineered mice. Nature Reviews CanCer, 9:831-841.
YORK/编译
1. 双刃剑:p53的前景与风险
有五项研究表明,肿瘤抑制蛋白p53失活将会提高干细胞的制备效率。这些研究成果是否昭示了癌症细胞与干细胞拥有令人不安的相似性?
大部分人类癌症都会出现肿瘤抑制蛋白p53失活突变,因此,p53活性在肿瘤形成过程中的作用与调控机制成为了人们的研究热点,人们希望能从它身上找到攻克癌症的良方妙法。p53基因发生种系遗传性突变促进了小鼠与人类癌症的发生发展,而p53基因发生缺失突变后与各种突变基因相互作用则会将正常细胞转变为肿瘤细胞。
p53是压力应激蛋白,它能通过以下三条途径抑制肿瘤的形成:
1. 触发程序性细胞死亡(细胞凋亡);
2. 激活能阻止受损细胞增殖的细胞周期检验点;
3. 促进细胞衰老(永久性细胞周期阻滞)。
鉴于此,p53失活有利于癌变细胞增殖从而导致基因组极其不稳定。有五篇论文指出p53失活能提高iPS细胞的制备效率。尽管这些发现令p53迅速成为干细胞研究的核心,但时间会告诉我们究竟它是机遇还是挑战。
2006年,研究人员将4个转录因子——c-Myc、Klf4、Sox2以及Oct4通过一种逆转录病毒载体导入小鼠皮肤成纤维细胞中,使来自胚胎小鼠或者成年小鼠的不同纤维原细胞拥有胚胎干细胞的多样性。他们将经由这种方法获得的胚胎干细胞命名为iPS细胞。这些细胞与来自哺乳动物早期胚胎的胚胎干细胞(ES细胞)具有相同的特性,它们都能自我更新,并且能够生成机体所有类型的组织。ES细胞具有治疗各种疾病的潜力;鉴于iPS细胞可以经由任何个体的成体细胞产生,理论上,采用iPS细胞可以避免采用ES细胞带来的伦理问题,并可以满足与细胞捐献者免疫匹配的需要。此外,尽管现在对iPS细胞的研究开展得如火如荼,但究竟iPS细胞是否人类疾病的良方还有待考证。事实上,就连胚胎来源的ES细胞也仅仅接受过为数不多的测试,其有效性以及安全性还需进一步验证。
目前已有的iPS细胞制备方法效率较低。起初,人们通过表达致癌基因c-Myc以及往感受性强的基因组中随机插入外源DNA(包括用作载体的病毒DNA)来制备iPS细胞。这些方法都可能会引发癌症。随后,研究人员建立了新方法来制备iPS细胞。这种方法无需c-Myc参与、没有病毒整合过程,仅仅采用蛋白就能进行重编程。事实上,对iPS细胞的制备研究风行一时,这令人回想起以前癌基因首次发现的情景,当时研究人员争相鉴定能令正常细胞永生化,也即转变为癌症细胞的首个基因以及多基因组合。
新研究表明p53失活能明显提高iPS细胞的制备效率,这大大激发了人们对iPS细胞的研究热情。此外,Kawamura等人表明p53缺失简化了iPS的制备过程,因为只需两个因子Oct4以及Sox2就能制备出iPS细胞。此外,三个研究小组表明,植入小鼠胚胎的p53缺失型iPS细胞可以产生成体组织。
因为p53失活能加剧基因组的不稳定以及导致癌症发生,所以p53缺失型iPS细胞的制备过程的风险可能大于得益。与此观点一致的是,Marión等人揭示了p53缺失型iPS细胞的基因组非常不稳定,无法有效地生长发育成小鼠。并且,即使Hong等人研究发现部分p53缺失型iPS细胞能生长发育成小鼠,这些小鼠最终都会罹患癌症。为了解决这些安全问题,Utikal等人证明了短暂的非永久性地抑制p53同样可以提高重编程的效率。而且,要想将p53抑制型iPS细胞用于治疗,就必须保证重构组织的功能正常并且无致癌因素。另外,必须同时采用下一代测序技术以及其它基因组技术来证明这些细胞没有携带有害突变。
p53抑制型iPS细胞除了可用于治疗外,几篇论文之间关于p53限制重编程的机制的观点有相同也有对立,尤其在关于p53与重编程途径之间究竟发生了直接还是间接的相互作用还没有定论。Li等人指出,iPS细胞重编程过程中,Ink4a/Arf位点(编码细胞周期抑制剂——p16Ink4a以及p53间接激活剂——p19Arf)被沉默了。他们认为沉默发生在重编程早期,暗示了重编程因子对这个位点有直接影响。然而,关于Ink4a/Arf在重编程过程中表达何时被下调却没有达成共识。
通过活化p53介导的压力应激(例如,细胞凋亡或衰老),可以研究重编程因子与p53之间间接的相互作用。有三个研究小组提供了证据,说明在这个相互作用过程中,一个关键的p53效应子是细胞周期抑制剂p21。事实上,Gil等人指出细胞衰老是重编程的主要障碍。人们现在已经知道,培养基中,拥有完整p53的细胞很容易衰老,这也学解释了为什么正常细胞更难重编程的原因。鉴于此,Utikal等人指出,培养基中的有或没有p53明显失活的自发永生性细胞很容易被制备成iPS细胞。
从表面看来,这些结果容易令人想起以前的工作,也就是发表于25年前的关于p53缺失有利于细胞永生化的观点。所谓永生化,就是细胞无休止地自我更新,这是癌症发生的第一步。最近,p53被看作限制某些干细胞的自我更新能力的因子。甚至在iPS研究领域,之前的工作也证明利用SV40T抗原(能使p53失活的永生化癌基因蛋白)或采用小干扰RNA暂时抑制p53都能增加重编程效率。现在的研究大大扩展和延伸了这些结果,并为人们更有效地研究重编程提供了一个新的平台。
研究重编程过程与癌基因转化过程的惊人相似性可以为人们研究癌症发生发展提供一个独特的视角(图1)。事实上,这两个过程都需要特定的基因相互协助。这些基因能产生未完全分化的细胞(可以增殖并无限制地自我更新)。以前所说的能重编程细胞的4个因子至少在多种肿瘤中过表达,而其中的c-myc和Klf4更已被证实为癌基因。现在我们发现p53失活将大大提高癌基因将正常细胞转化为肿瘤细胞的效率,当然,同时也有利于重编程过程的发生发展。很明显,iPS细胞形成与否的检测技术事实上也是肿瘤基因检测技术,这种检测技术可衡量iPS被植入小鼠后形成生殖细胞肿瘤的能力。

图1 控制iPS细胞形成与癌细胞形成的机制互相重叠。正常的成熟、已分化的成纤维细胞可以通过某些因子作用而重编程成为iPS细胞或肿瘤细胞。a,转录因子c-Myc和Klf4促进了成纤维细胞重编程为iPS细胞的速率。它们在正常细胞转化为肿瘤细胞的过程中发挥了同样的作用。尽管Oct4以及Sox2在肿瘤中过表达,但是人们认为它们在促进iPS细胞的形成过程中起到了特定作用;b,相反,p53肿瘤抑制蛋白(可由p19Arf诱导而来)通过靶蛋白,即细胞周期抑制子p21诱导细胞凋亡或衰老,直接或间接限制了成纤维细胞重编程为iPS细胞或肿瘤细胞。另一个细胞周期抑制子p16Ink4a也能直接限制上述两个过程来促进细胞衰老。Ink4a/Arf位点(图中没标出,它编码p19Arf以及p16Ink4a)在iPS重编程过程中被沉默了。
如果这个过程在诱导iPS细胞生成的同时会引发肿瘤,那么人们就需要思考这种所谓的肿瘤干细胞——具有自我更新能力,被看作为许多肿瘤细胞扩散的必要条件——是否会在重编程样(reprogramming-like)机制中最先出现。然而,并非所有因子(细胞重编程为iPS细胞所必须)都是这个过程所必须的。如果癌症在重编程样过程中发生,那么也许许多能引发肿瘤形成的癌基因都是可有可无的,因此,它们也就无法作为好的癌症治疗靶标了。如果真是这样,有关重编程的进一步研究可能最终会为癌症治疗提供一个新方法。
原文检索:
Valery Krizhanovsky and Scott W. Lowe. (2009) The promises and perils of p53. Nature, 460(27):1085-1-86.
悠然/编译
2. 图片阅读
与p53相互作用的蛋白

p53-interacting proteins:与p53相互作用的蛋白;
Selectively stimulate Cell cycle regulators:选择性地刺激细胞周期调控因子;
DNA-binding core:DNA结合区;
Selectively stimulate apoptotic regulators:选择性地刺激凋亡调控因子;
p53抑制肿瘤的机理
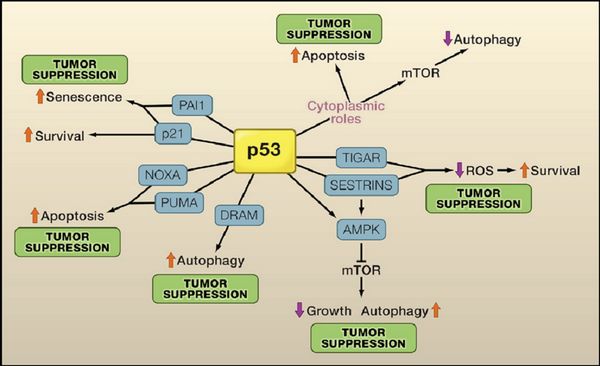
TUMOR SUPPRESSION:抑制肿瘤生成;
Apoptosis:细胞凋亡;Autophagy:细胞自噬;Senescence:衰老;Survival:存活;
Cytoplasmic roles:细胞质的作用;Growth:生长;
p53的生理功能和病理作用

Tumor suppression:抑制肿瘤生成;Development:发育;Stem cell modulation:干细胞调控;
Fertility:生殖;Ischemia:局部缺血;Treacher Collins Syndrome:Treacher Collins综合征;
Neurodegeneration:神经退行性变;Aging:老化;Apoptosis:细胞凋亡;Autophagy:细胞自噬;Cell cycle arrest:细胞周期阻滞;DNA repair: DNA修复; Embryo implantation: 胚胎植入; Inhibition of angiogenesis: 抑制血管生成; Inhibition of ROS/Survival: ROS/存活抑制; Innate immunity: 先天免疫; Metabolism:代谢; p53 regulation: p53调控; Senescence:衰老;
原文检索: http://cmbi.bjmu.edu.cn/news/report/2009/p53.html
悠然/编译
全部作者的其他最新日志
热门日志导读
- • 感受
- • 努力挣威望
- • “干细胞”滥用:救命还是敛财?
- • 慢慢体会的小故事
- • 细胞培养板的选择
- • miRNA-操纵干细胞命运




